L'équipe Biologie des leucémies de l'enfant est rattachée à l’UMR 1170 Dynamique moléculaire de la transformation hématopoïétique. L'équipe fait partie du réseau des leucémies de l'enfant CONECT-AML, du programme intégré en cancérologie pédiatrique Paris Kid Cancer, de Institut Carnot OPALE, de la Fédération d’Hématologie de l’Université Paris Saclay et coordonne le programme national PEDIAC.
Les cancers pédiatriques touchent environ 1 enfant sur 600 et représentent la deuxième cause de mortalité chez l'enfant en France. Les caractéristiques cliniques des cancers pédiatriques suggèrent qu'ils ont une base moléculaire différente de celle des cancers similaires chez l'adulte. Alors que des altérations génétiques récurrentes ont été identifiées au cours des dernières années, des analyses fonctionnelles sont maintenant nécessaires pour identifier comment une cellule normale devient leucémique, pourquoi certaines altérations sont spécifiques de l'enfance et quels sont les mécanismes à l'origine des cellules leucémiques qui peuvent être ciblés pour de nouvelles perspectives thérapeutiques.
Les hémopathies malignes représentent 45 % des cancers pédiatriques. Elles affectent l'hématopoïèse qui est généralement décrite comme une hiérarchie présentant, en son sommet, des cellules souches hématopoïétiques (CSH) qui possèdent une capacité unique de transition entre quiescence et un potentiel d'autorenouvellement à long terme, ainsi que la capacité de générer divers progéniteurs qui prolifèrent puis de différencient pour donner les cellules fonctionnelles matures du sang. Les leucémies aiguës myéloïdes (LAM) sont caractérisées par une accumulation de progéniteurs hématopoïétiques anormaux bloqués dans leur différenciation. Les LAM présentent des altérations génétiques récurrentes, telles que des oncogènes de fusion.
Nos axes principaux d'étude sont:
- 1 - Étudier le lien entre les voies de réponse au stress et la plasticité métabolique dans l'hématopoïèse normale et maligne.
L'objectif est de déchiffrer la réponse au stress des cellules souches saines et leucémiques pour identifier de nouvelles vulnérabilités métaboliques permettant de cibler les cellules leucémiques tout en épargnant les cellules normales. - 2 - Caractériser les trajectoires cellulaires et moléculaires au cours du développement des leucémies.
L'objectif est d'identifier les mécanismes à l'origine de la leucémie, comment une cellule normale devient leucémique et pourquoi certaines altérations sont spécifiquement diagnostiquées pendant l'enfance. - 3 - Identifier les dépendances fonctionnelles et effectuer des analyses précliniques.
L'objectif est de mettre en évidence les mécanismes qui représentent des vulnérabilités spécifiques des cellules leucémiques et de tester l'efficacité de nouvelles stratégies de ciblage de ces mécanismes dans des analyses précliniques.
Lien entre les voies de réponse au stress et la plasticité métabolique dans l'hématopoïèse normale et maligne
(Responsable: Marie-Laure Arcangeli)
Notre groupe se concentre sur l'étude du lien entre les voies de réponse au stress, la plasticité métabolique et épigénétique dans l'hématopoïèse normale et maligne. Les CSH sont souvent la cellule d'origine des leucémies. Dans les leucémies agressives, les rémissions sont souvent suivies d'une rechute, en partie due à l'existence de cellules souches leucémiques (CSL) résistantes qui se sont adaptées au stress induit par le traitement en détournant les propriétés fonctionnelles des CSH. Il est donc nécessaire d'élucider les mécanismes par lesquels les CSH et les CSL s'adaptent au stress (équilibre entre quiescence et auto-renouvellement), ceci inclut les programmes épigénétiques et métaboliques. Notre objectif est de déchiffrer la réponse au stress des cellules souches saines (CSH) et leucémiques (CSL) afin d’identifier de nouvelles vulnérabilités métaboliques permettant de cibler les cellules leucémiques tout en épargnant les cellules normales.
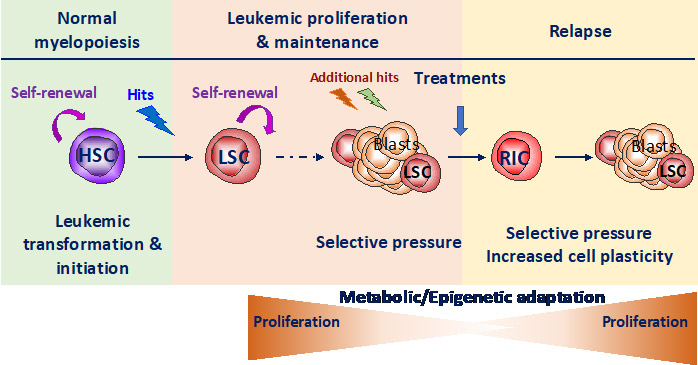
Les observations indiquent qu'une fois activées, les CSH activent les voies de réponse au stress et s'adaptent au stress en particulier en modulant les voies métaboliques qui peuvent induire la modification des protéines codées par les gènes épigénétiques. Le stress induit des changements drastiques dans le programme transcriptionnel des CSH avec une progression d’une signature des cellules souches vers celle des progéniteurs et une modification du profil transcriptionnel des régulateurs épigénétiques (par exemple DNMT3a, TET2/3, IDH1/2 et ASXL1, Henry et al Stem cell Transl Med 2023). Le contrôle de la réponse au stress oxydatif permet une protection partielle mais essentielle des propriétés fondamentales des CSH (Henry et al Stem cell Transl Med 2023 et Henry et al Haematologica 2020, Exp Hematol 2020). Enfin, nous montrons que la protéine de réponse au stress REDD1 participe à la protection des CSH en modulant les niveaux de ROS (Barroca et al Leukemia 2022). La surexpression de REDD1 est associée à un mauvais pronostic et à une résistance aux traitements dans la LAM et d'autres observations suggère que REDD1 est un intermédiaire entre les voies de réponse au stress et le métabolisme avec des conséquences sur la régulation épigénétique.
Nous suivons, d'une part, une approche de gène candidat, pour comprendre les connections entre le gène DDIT4 codant la protéine REDD1, le programme antioxydant, le métabolisme et le stress dans les CSH humaines et murines et les cellules de leucémie myéloïde (par inactivation de REDD1 dans différents modèles de cellules humaines, PDX et souris déficientes Ddit4-/-). D'autre part, nous décrypterons la fonction de REDD1 dans la résistance aux traitements. Cette partie est financée par un INCA PLBIO (2024-2026) en collaboration avec JE Sarry (CRCT/IRCM, Toulouse/Montpellier).
Plus généralement, nous combinerons des approches à haut débit sur des lignées cellulaires humaines de LAM et des cellules primaires de souris (séquençage combiné de l'ARN et criblage avec une librairie CRISPR ciblant le métabolisme et/ou l'épigénétique) pour décrypter quelles voies de réponse au stress sont activées et quelles voies épigénétiques et métaboliques sont remodelées. En effet, nous visons à découvrir des vulnérabilités métaboliques dans les LSC qui restaurent ou re-sensibilisent aux traitements actuels.
Caractériser les trajectoires cellulaires et moléculaires au cours du développement des leucémies
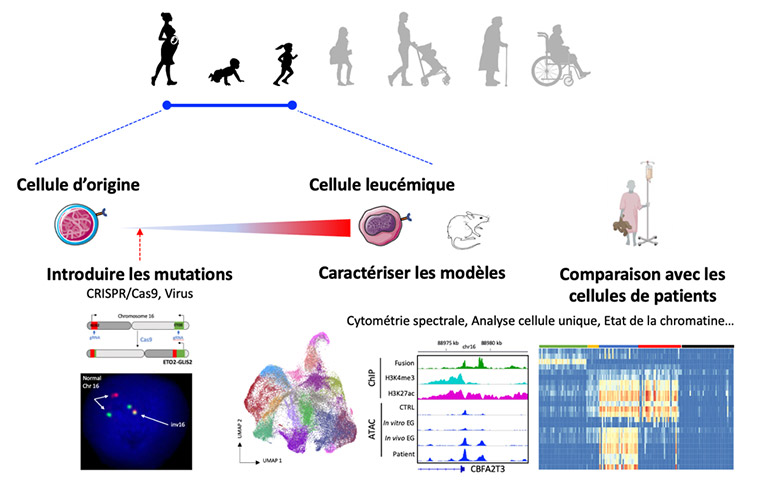
Nous caractérisons les altérations génétiques et épigénétiques trouvées dans la leucémie et développons des modèles pour comprendre la contribution fonctionnelle de chaque altération ainsi que du stade de développement de la cellule d'origine à l'initiation de la leucémie.
Nous avons concentré nos travaux sur les leucémies aiguës à mégacaryoblastes (LAM-M7) pédiatriques et les érythroleucémies (LAM-M6), toutes deux généralement associées à une mauvaise réponse aux traitements et à un pronostic défavorable.
Leucémie aiguë mégacaryoblastique pédiatrique
Nous avons identifié plusieurs mutations récurrentes conduisant à l'expression d'oncogènes de fusion impliquant des régulateurs de l'expression des gènes (ex: OTT-MAL et ETO2-GLIS2) (Mercher et al, PNAS 2001; Thiollier et al, JEM 2012). ETO2-GLIS2 est associé à un pronostic très défavorable. Nous avons montré que la fusion ETO2-GLIS2 se lie à l'ADN par l'intermédiaire des parties ETO2 et GLIS2, y compris au niveau de régions régulatrices de la transcription appelées «enhancers». La fusion contrôle l'expression de facteurs de transcription importants et entraîne une expression élevée de ERG (essentiel pour les cellules immatures et l'expression du récepteur KIT au facteur de croissance SCF) et une expression faible de GATA1 (un régulateur de la différenciation des cellules érythroïdes et mégacaryocytaires). En collaboration avec C. Lobry et J. Chaumeil, nous avons découvert que la fusion contrôle l'organisation de la chromatine au locus KIT/PDGFRA, important pour la survie et la prolifération des cellules leucémiques (Benbarche et al. Science Adv 2022). Récemment, nous avons observé que la fusion induit un effet antagoniste sur les régulateurs de la survie cellulaire. En effet, ETO2-GLIS2 induit l'activation de la caspase 3 et la mort cellulaire dans des cellules naïves tandis que les cellules leucémiques ETO2-GLIS2 présentent une forte expression de BCL2 (Aid et al. Leukemia 2023).
Leucémie aiguë érythroïde
Nous avons développé avec le groupe du Dr J. Schwaller (Bâle, Suisse) un travail collaboratif impliquant de nombreuses équipes de Gustave Roussy (Dr S. DeBotton et Dr J.B. Micol), de centres cliniques français (Dr E. Delabesse : Toulouse , Dr D. Birnbaum : Marseille, Dr L. Garcon : Amiens), de centres européens (Dr P. Vyas : Angleterre, Dr E. Anguita : Espagne, Dr C. Dierks : Allemagne, Dr A. Rambaldi : Italie, Dr P. Valent : Autriche) et de centres internationaux (Dr M. Caroll : États-Unis, Dr J. Maciejewski : États-Unis, Dr S. Kazuya : Japon, Dr C. Carmichael : Australie) pour étudier les LAM-M6 humaines. Nous avons identifié des altérations génétiques et transcriptionnelles et classé les patients LAM-M6 en plusieurs sous-groupes moléculaires. Il est important de noter que des altérations des facteurs impliqués dans les complexes transcriptionnels GATA1 tels que ERG, ETO2 ou SKI sont retrouvées dans au moins 18 % des échantillons de patients et contribuent fonctionnellement à la transformation des progéniteurs érythroïdes (Fagnan et al Blood 2020).
Modélisation de l'initiation de la leucémie
Nous avons développé un modèle murin d'expression d'ETO2-GLIS2 inductible par la doxycycline (coll. avec J. Schwaller, Bâle, Suisse) qui 1-a conduit au développement d'une leucémie lors de l'induction de l'expression d'ETO2-GLIS2, 2-a montré que les cellules fœtales sont plus permissives à la transformation par fusion que les cellules adultes et 3-a montré que le phénotype de la leucémie est associé à l'activité de plusieurs facteurs de transcription, dont GATA1 et CEBPA (Lopez et al. Cancer Discovery 2019).
Nous développons actuellement des modèles d'expression de la fusion ETO2-GLIS2 à partir de cellules humaines normales à travers deux approches. Premièrement, nous utilisons des cellules souches pluripotentes induites (IPS) pour leur capacité à récapituler les premières étapes de l'hématopoïèse embryonnaire humaine. Dans un premier modèle, nous avons montré que la fusion altère la différenciation des mégacaryocytes, augmente l'auto-renouvellement des progéniteurs et récapitule les dérégulations transcriptionnelles observées chez les patients mais n'induit pas de leucémie in vivo (Bertuccio et al Hemasphere 2020). Pour améliorer le modèle, nous effectuons actuellement une modification ciblée du génome des IPS à l'aide de l'approche CRISPR/Cas9 pour recréer l'altération chromosomique précisément trouvée dans les cellules du patient. Nous collaborons également avec l'équipe du Dr F. Pflumio (CEA, Fontenay-aux-roses) pour l'utilisation de cellules humaines primaires à différents stades de développement. Ces modèles sont étudiés à l'aide de techniques cellulaires et moléculaires, notamment les transcriptomes unicellulaires (scRNAseq), l'accessibilité de la chromatine (ATAC-seq), la spectrométrie de masse pour les interactions protéiques, la cytométrie en flux spectrale.
Identifier les dépendances fonctionnelles des leucémies & tests précliniques
La caractérisation de complexes transcriptionnels altérés par les oncogènes de fusion ou l'identification de cibles transcriptionnelles directes permet de révéler des candidats qui peuvent être ciblés par de nouvelles stratégies dans les tests précliniques.
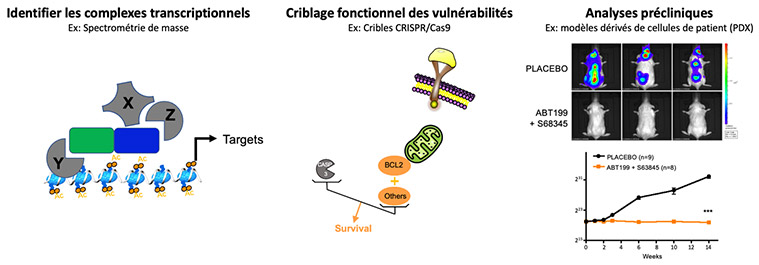
Nous avons montré que le programme transcriptionnel imposé par ETO2-GLIS2 dépend de l'interaction fonctionnelle entre ETO2-GLIS2 et ETO2 via le domaine NHR2 d'ETO2. En effet, l'expression ectopique d'un peptide interférant avec le domaine NHR2 inhibe l'expression de gènes associés aux enhancers, rétablit l'équilibre d'expression des facteurs ERG et GATA1 et inhibe la prolifération des cellules leucémiques ETO2-GLIS2 dans les modèles in vivo. Ces données établissent qu'une interférence fonctionnelle avec l'activité des complexes transcriptionnels impliquant ETO2-GLIS2 est capable d'inhiber la prolifération/survie des cellules leucémiques (Thirant et al. Cancer Cell 2017, Lopez et al. Trends in Cancer 2017). De plus, dans la continuité des travaux sur l'érythroleucémie mettant en évidence le rôle de l'ETO2 dans la transformation, des études en cours identifient certains des mécanismes contrôlant le rôle positif de l'ETO2 sur l'activation transcriptionnelle. L'objectif de cette partie est de trouver les membres du complexe transcriptionnel qui sont essentiels à la fusion et dont l'activité peut-être ciblée.
Issue du lien entre ETO2-GLIS2 et la régulation de la mort/survie cellulaire, une redondance fonctionnelle entre BCL2 et MCL1, révélée en collaboration avec P. Auberger (C3M, Nice), rend les cellules ETO2-GLIS2 pratiquement insensibles à l'inhibition par les inhibiteurs de BCL2 ou MCL1 seuls, mais très sensible à une inhibition combinée, y compris dans les modèles PDX in vivo (Aid et al. Leukemia 2023). Suite à ces travaux, nous collaborons avec des experts en pharmacologie (Dr F.X. Legrand, Université Paris Saclay) afin de pallier les toxicités actuelles liées à l'association de ces molécules.
Dans le cadre d'une collaboration dirigée par E. Brunet (Institut Imagine), nous contribuons au développement de modèles de lymphome anaplasique à grandes cellules (ALCL) avec la fusion NPM1-ALK. Ce travail a identifié ROR2, en tant que nouveau marqueur de surface exprimé de manière unique à la surface des cellules NPM1-ALK à la fois dans les modèles et chez les patients (Babin et al iScience 2018 & Molecular Cancer 2022). Ce travail a fourni une cible pour le développement d'une nouvelle stratégie d'immunothérapie dans les ALCL qui acquièrent une résistance aux thérapies actuelles.
