Le 14 novembre 2023,
Un organoïde neuronal équipé d'un environnement immunitaire
Des chercheurs français, singapouriens et anglais, menés par le Pr Florent Ginhoux, directeur d’une équipe de recherche à Gustave Roussy/Inserm, ont réussi à mettre en évidence dans un organoïde neuronal le rôle de l’environnement immunitaire du cerveau dans sa formation et son développement. La mise au point de ces structures en trois dimensions intégrant cellules neuronales et environnement immunitaire, est, à ce jour, un des modèles in vitro qui reflète de manière la plus complète le cerveau humain. Ces travaux sont publiés dans la revue Nature.
À Gustave Roussy, ces organoïdes sont utilisés pour modéliser le développement des cancers du cerveau de l’enfant, pour en comprendre les mécanismes et découvrir de nouvelles pistes de traitement.
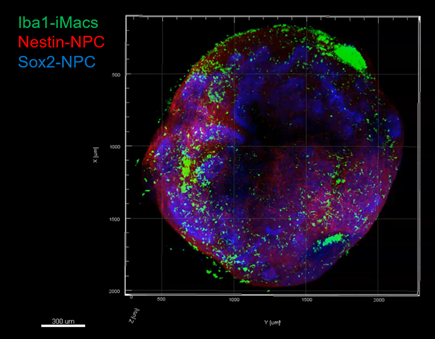
Organoïde neuronal avec environnement immunitaire grossi deux fois à gauche, 20 fois à droite : en vert les macrophages, en rouge et bleu les cellules neuronales progénitrices (microscopie à fluorescence)
« Si l’on sait que les cellules microgliales, cellules immunitaires issues de l’évolution (différenciation) de macrophages primitifs présents dans le cerveau embryonnaire, contribuent à de multiples aspects du développement et du fonctionnement du cerveau, leur rôle précis reste mal connu et peu étudié », déclare le Pr Florent Ginhoux, directeur d’une équipe de recherche à Gustave Roussy/Inserm et chercheur au Singapore Immunology Network A*STAR (SIgN) au moment des travaux. L’utilisation d’organoïdes neuronaux pour étudier leurs fonctions est une des voies aujourd’hui privilégiée par la recherche.
Un organoïde est une structure en 3D cultivée au laboratoire qui reproduit certaines caractéristiques morphologiques et fonctionnelles d’un organe ou d’un tissu du corps humain. En recherche, ces pseudo-organes issus de cultures cellulaires sont un nouveau modèle biologique en plein développement dans différents domaines, notamment en neurologie ; la plupart des études portant sur la formation des neurones (neurogenèse) étant réalisée à partir de modèles animaux.
Avec une structure en 3D, le fonctionnement et les propriétés de ces organoïdes se rapprochent de ceux d’un véritable organe sans pour autant être aussi abouti. Ils mesurent un millimètre et n’ont pas de pensées, de conscience ou d’émotion. En générant des organoïdes neuronaux à partir de cellules souches pluripotentes humaines induites dites « cellules iPS » (cellules spécialisées qui sont déprogrammées pour être reprogrammées différemment), il est possible de modéliser certaines caractéristiques clés du développement précoce du cerveau humain. « Cependant, les approches actuelles n’intègrent pas les cellules microgliales », précise le Pr Florent Ginhoux.
L’équipe internationale de chercheurs dirigée par le Pr Florent Ginhoux, a réussi à produire un nouveau type de modèle : des organoïdes neuronaux pourvus de microglie en cultivant ensemble des organoïdes, et des macrophages de type primitif, tous générés à partir d’une même culture de cellules souches induites iPS.
Les organoïdes et les macrophages de type primitifs sont d’abord préparés séparément. Il faut environ 25 jours pour les obtenir. Les macrophages sont ensuite mis au contact des organoïdes pendant 15 à 20 jours supplémentaires.
Dans le modèle que les chercheurs ont développé, les macrophages ont colonisé les organoïdes. Dans cet environnement 3D, en contact avec les cellules neuronales immatures, ils se sont différenciés en de cellules microgliales exprimant les gènes et les fonctions propres à ce type cellulaire. Ces cellules microgliales se sont révélées capables de contrôler la différenciation de précurseurs de neurones (dites cellules progénitrices neuronales), limitant ainsi leur multiplication (prolifération), tout en favorisant la création de synapses (synaptogenèse) et la croissance des axones (axonogenèse), deux éléments clés de la transmission du message nerveux de neurone à neurone.
Une découverte dans la découverte
L’équipe du Pr Florent Ginhoux a également observé que les cellules microgliales des organoïdes contiennent des niveaux élevés de périlipine 2, une molécule appartenant à une famille de protéines qui enrobent les lipides – dont le cholestérol – dans des gouttelettes, ce qui permet leur stockage dans les cellules et leur exportation hors de ces dernières. Armées de ces gouttelettes chargées en périlipine 2, les cellules microgliales facilitent le transport du cholestérol vers les organoïdes. Les cellules progénitrices neuronales qui absorbent ce cholestérol subissent alors une véritable reprogrammation métabolique durant leur processus de différenciation en cellules nerveuses.
L’approche développée par le Pr Florent Ginhoux et ses collaborateurs fait progresser de manière très significative la complexification des modèles d’organoïdes en y intégrant des cellules microgliales. Progrès que les chercheurs ont illustré par la découverte d’une voie clé de dialogue, portée par les lipides, entre la microglie et les cellules progénitrices neuronales, primordiale pour la synthèse de nouveaux neurones.
« Avec les cellules de la microglie incorporées, les organoïdes neuronaux que nous avons réussi à générer sont un nouveau modèle 3D plus complet et plus proche de la réalité. Nous savons que le système immunitaire joue un rôle fondamental dans le développement des cancers et à Gustave Roussy nous allons donc les utiliser pour mieux comprendre et découvrir les mécanismes qui régulent le développement des tumeurs cérébrales pédiatriques », conclut le Pr Florent Ginhoux.
Ces travaux ont été soutenus par la campagne « Guérir le cancer de l’enfant au 21e siècle » de la Fondation Gustave Roussy.
Source
Nature
iPSC-microglia promote brain organoid maturation via cholesterol transfer
Publié le 9 novembre, publication avancée en ligne le 1er novembre 2023
