Groupe Polymérases translésionnelles et cancer
Ce groupe est rattaché à l’équipe "Intégrité du génome, Réponse immunitaire et Cancers".
L'instabilité génétique, caractéristique majeure des cellules cancéreuses, joue un rôle central dans le processus tumoral et se produit essentiellement lors de la duplication du génome. Au cours de la phase S, le principal danger est la présence de barrières naturelles (e.g. structures secondaires de l’ADN) ou de lésions qui peuvent bloquer la progression des fourches de réplication, altérer l’efficacité et la fidélité de la réplication, voire conduire à des cassures double brin générant ainsi de l’instabilité génétique. Des mécanismes de « tolérance aux dommages » sont employés par la cellule pour assurer la reprise de la synthèse d’ADN.
L’arrêt des fourches de réplication peut également activer les points de contrôle de la phase S (checkpoint) qui jouent un rôle crucial :
- en stabilisant les fourches de réplication bloquées et
- en ralentissant le cycle cellulaire afin que la cellule réplique tout son génome avant la division cellulaire.
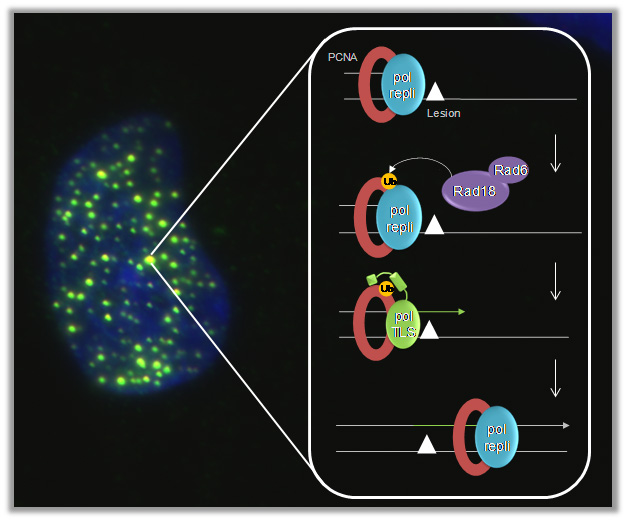
Légende : (à gauche) localisation intranucléaire de la polymérase translésionnelle eta détectée par immunofluorescence, (à droite) représentation schématique du processus de synthèse translésionnelle.
Ce processus peut être fidèle ou mutagène. La TLS contribue donc à la survie des cellules au risque d’introduire des mutations dans le génome pouvant être à l’origine du processus de cancérogenèse. Une avancée spectaculaire dans la compréhension de cette voie de tolérance aux dommages de l’ADN a eu lieu pendant les deux dernières décennies. En effet, ces ADN polymérases spécialisées, appelées pol eta, iota, kappa, zeta et Rev1 ont été bien caractérisées pour leur capacité à franchir différents types de lésions in vitro. Cependant, il reste encore beaucoup à faire pour comprendre leur mode d’action in cellulo. Ainsi, déterminer la régulation des ADN polymérases spécialisées suite à un stress réplicatif et/ou génotoxique est une étape incontournable pour comprendre leur implication dans l’instabilité génétique et démontrer un lien direct entre mutagenèse et cancérogenèse. Notre projet vise également à définir comment les processus d’activation de checkpoints et de synthèse translésionnelle sont coordonnés à la fourche pour stabiliser le complexe de réplication après un stress réplicatif dans les cellules humaines.
Récemment, nous avons également initié un axe de recherche qui vise à comprendre comment l’information épigénétique est maintenue au cours de la duplication du génome suite à un stress réplicatif et la coordination de ce processus avec la réplication de l’ADN et les mécanismes de tolérance aux dommages.
