Villejuif, le 6 août 2020
Identification d’une nouvelle cible thérapeutique potentielle contre la Covid-19
Une étude menée par des chercheurs et médecins de Gustave Roussy, de l’Assistance Publique – Hôpitaux de Paris AP-HP, de l’Inserm , de l’Université Paris-Saclay et d’Université de Paris, en collaboration avec plusieurs équipes étrangères (Singapour, Chine, Israël), révèle que les patients atteints d’une forme grave de Covid-19 présentent un déficit des fonctions de l’immunité innée des cellules myéloïdes (fraction des globules blancs comme les polynucléaire neutrophiles, monocytes), associé à un taux très élevé de calprotectine, une protéine pro-inflammatoire de la famille des alarmines, dans le sang.
Publiés dans la prestigieuse revue Cell, ces résultats permettent de proposer un test diagnostique susceptible d’identifier rapidement les patients risquant de développer une forme sévère de la maladie et ouvrent la voie à une approche thérapeutique inédite : le blocage du récepteur de la calprotectine, une protéine pro-inflammatoire de la famille des alarmines.
Dirigés par Aymeric Silvin, chercheur en immunologie, spécialiste des cellules myéloïdes, au sein de l’Unité 1015 Gustave Roussy / Inserm / Université Paris-Saclay, ces travaux ont été réalisés en collaboration étroite avec le docteur Florent Ginhoux, éminent chercheur du Singapore Immunology Network (SIgN), la Professeure Michaela Fontenay, cheffe du service d’hématologie biologique de l’hôpital Cochin, APHP, et directrice d’équipe à l’Institut Cochin dans l’Unité 1016 Inserm / CNRS / Université de Paris, et le Professeur Eric Solary, de l’Unité 1287 Gustave Roussy / Inserm / Université Paris-Saclay.
L’étude s’est appuyée sur l’analyse d’échantillons sanguins provenant de 158 patients admis aux urgences pour suspicion de Covid-19. Parmi eux, 72 patients ont été testés négatifs par PCR et 86 se sont révélés positifs, en présentant trois degrés de sévérité de la maladie (léger, modéré, sévère).
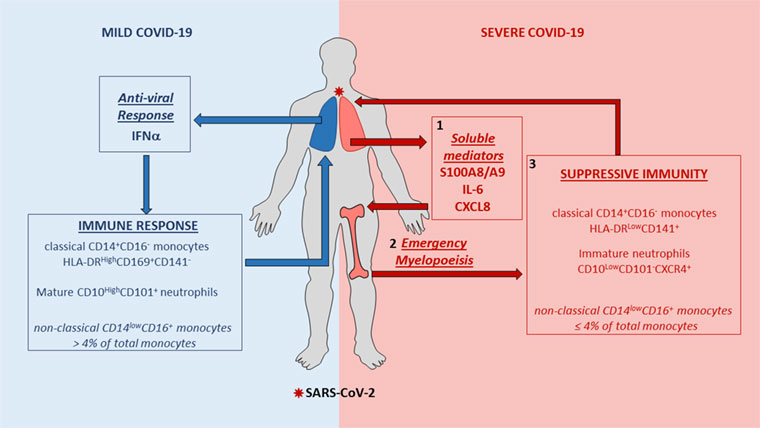
De multiples analyses des cellules sanguines de ces patients, notamment par cytométrie spectrale en flux, ont révélé des modifications de la production et de la répartition de certaines cellules myéloïdes du système immunitaire chez les patients atteints d’une forme grave de la Covid-19, aboutissant à une immunosuppression. Ces modifications incluent :
- Un nombre élevé de monocytes « classiques » sous exprimant l’antigène HLA-DR, favorisant l’immuno-suppression
- Une forte diminution des monocytes « non classiques », qui constituent habituellement 10% des monocytes mais représentent moins de 4% chez les patients sévères
- La libération de cellules myéloïdes correspondant à des polynucléaires neutrophiles immatures aux propriétés immunosuppressives (myélopoïèse d’urgence). Cette libération pourrait être liée à un taux très élevé de calprotectine.
En effet, l’analyse de multiples protéines du plasma sanguin a révélé un taux très élevé de calprotectine (taux normal multiplié par 100 à 1 000) chez les patients atteints de forme sévère de Covid-19. La calprotectine est une protéine générée dans un contexte inflammatoire.
«Nos résultats suggèrent que la calprotectine pourrait être responsable de l’aggravation de la Covid-19, puisque sa quantité corrèle avec les besoins en oxygène ainsi que les facteurs impliqués dans la thrombose, souligne Aymeric Silvin. La forte augmentation de calprotectine dans le sang pourrait intervenir avant l’orage cytokinique associé à l’emballement inflammatoire des patients développant une forme sévère. Nous pensons qu’une boucle d’amplification se crée entre la calprotectine et l’interleukine-6, induisant une inflammation chronique aboutissant à une immuno-suppression».
La Professeure Michaela Fontenay, cheffe du service d’hématologie biologique de l’hôpital Cochin, AP-HP, précise qu’«un diagnostic précoce d’une forme grave peut être réalisé par la combinaison d’un dosage de calprotectine et d’un test de routine de cytométrie en flux implantable dans les laboratoires d’hématologie. Un test de routine équivalent a déjà été déployé en France dans le but de faciliter le diagnostic d’une maladie hématologique.»
Ces résultats inédits permettent d’envisager de nouvelles stratégies thérapeutiques pour contrer l’aggravation de la Covid-19, en bloquant par exemple les récepteurs de la calprotectine et la myélopoïèse d’urgence. Ces stratégies sont à évaluer par des essais cliniques. Des discussions ont démarré pour repositionner un médicament anticancéreux dans cette indication.
Les conclusions de l’étude indiquent aussi que les taux de calprotectine et de monocytes non classiques dans le sang constituent des marqueurs susceptibles d’identifier les patients qui vont développer une forme grave de Covid-19. L’analyse de ces biomarqueurs pourrait être effectuée en routine. «Le diagnostic précoce d’une forme grave de la Covid-19 peut être réalisé sur un tube de sang en combinant un dosage de la calprotectine et un test de cytométrie en flux facilement implantable dans les laboratoires d’hématologie de routine, indique Pre Michaela Fontenay. Un test équivalent a été déployé ces dernières années en France dans le but de faciliter le diagnostic d’une maladie hématologique».
Cette étude a pu être réalisée grâce au soutien financier d’Amazon et de la Fondation Carrefour, des mécènes de Gustave Roussy, et du centre national de médecine de précision PRISM, soutenu par l’Agence Nationale de la Recherche.
Source
Elevated calprotectin and abnormal myeloid cell subsets discriminate severe from mild COVID-19
Aymeric Silvin,1 Nicolas Chapuis,2,3 Garett Dunsmore,1 Anne-Gaëlle Goubet,1 Agathe Dubuisson,1 Lisa Derosa,1,4 Carole Almire,2 Clémence Hénon,5 Olivier Kosmider,2,3 Nathalie Droin,6,7 Philippe Rameau,7 Cyril Catelain,7 Alexia Alfaro,7 Charles Dussiau,2,3 Chloé Friedrich,2,3 Elise Sourdeau,8 Nathalie Marin,9 Tali-Anne Szwebel,10 Delphine Cantin,8 Luc Mouthon,3,10 Didier Borderie,11 Marc Deloger,7 Delphine Bredel,1 Severine Mouraud,1 Damien Drubay,12 Muriel Andrieu,3 Anne-Sophie Lhonneur,13 Véronique Saada,14 Annabelle Stoclin,15 Christophe Willekens,6,16 Fanny Pommeret4, Frank Griscelli,4,14 Lai Guan Ng,17 Zheng Zhang,18 Pierre Bost,19,20 Ido Amit,20 Fabrice Barlesi,4 Aurélien Marabelle,1,21 Frédéric Pène,3,9 Bertrand Gachot,15 Fabrice André,4,5,22 Laurence Zitvogel,1,22,23 Florent Ginhoux,17,24,25* Michaela Fontenay,2,3* and Eric Solary6,15,22*
- INSERM U1015, Gustave Roussy Cancer Campus, 94800 Villejuif, France.
- Service d’hématologie biologique, AP-HP, Hôpital Cochin, 75014 Paris, France.
- Université de Paris, Institut Cochin, CNRS UMR8104, INSERM U1016, 75006 Paris, France.
- Département d’Oncologie Médicale, Gustave Roussy Cancer Campus, 94800 Villejuif, France.
- INSERM U981, Gustave Roussy Cancer Campus, 94800 Villejuif, France.
- INSERM U1287, Gustave Roussy Cancer Campus, 94800 Villejuif, France.
- INSERM US23, CNRS UMS 3655, Gustave Roussy Cancer Campus, 94800 Villejuif, France.
- Service des Urgences, AP-HP, Hôpital Hôtel-Dieu, 75014 Paris, France.
- Service de Médecine Intensive et Réanimation, AP-HP, Hôpital Cochin, 75014 Paris, France.
- Service de Médecine Interne, AP-HP, Hôpital Cochin, 75014 Paris, France.
- Service de Diagnostic Biologique Automatisé, AP-HP, Hôpital Cochin, 75014 Paris, France.
- INSERM U1018, Gustave Roussy Cancer Campus, 94800 Villejuif, France.
- Laboratoire de virologie, AP-HP, Hôpital Cochin, 75014 Paris, France.
- Département de biologie et pathologie, Gustave Roussy Cancer Campus, 94800 Villejuif, France.
- Service de réanimation médicale, Gustave Roussy Cancer Campus, 94800 Villejuif, France.
- Département d’hématologie, Gustave Roussy Cancer Campus, 94800 Villejuif, France.
- Singapore Immunology Network (SIgN), Agency for Science, Technology and Research (A*STAR), 8A Biomedical Grove, Immunos Building #3-4, Biopolis, Singapore 138648, Singapore.
- Institute for Hepatology, National Clinical Research Center for Infectious Disease, Shenzhen Third People’s Hospital, School of Medicine, Southern University of Science and Technology, Shenzhen 518112, Guangdong Province, China
- Systems Biology Group, Department of Computational Biology and USR 3756, Institut Pasteur and CNRS, 75015 Paris, France.
- Department of Immunology, Weizmann Institute of Science, Rehovot, Israel.
- Département d’Innovation Thérapeutique et d’Essais Précoces (DITEP), Gustave Roussy Cancer Campus, 94800 Villejuif, France.
- Université Paris-Saclay, Faculté de Médecine, 94270 Le Kremlin-Bicêtre, France.
- Centre d’investigation clinique - biothérapie, INSERM CICBT1428, 94800 Villejuif, France.
- Shanghai Institute of Immunology, Shanghai JiaoTong University School of Medicine, 280 South Chongqing Road, Shanghai 200025, China.
- Translational Immunology Institute, SingHealth Duke-NUS Academic Medical Centre, 169856, Singapore.
* Florent Ginhoux, Michaela Fontenay and Eric Solary share the last co-authorship
CONTACT PRESSE :
Claire Parisel – Tél. 01 42 11 41 75 – presse@gustaveroussy.fr
