
L'ACTUALITÉ EN CANCÉROLOGIE VUE PAR GUSTAVE ROUSSY
Newsletter #12 - Octobre 2021
Pathologie mammaire
L’immunothérapie prouve son efficacité dans le cancer du sein triple négatif

Anna Ilenko, Benjamin Verret
Présentées lors du congrès de l’ESMO qui s’est déroulé au mois de septembre, deux études ont démontré l’intérêt du pembrolizumab, un anticorps anti-PD-1, dans le cancer du sein triple négatif au stade localisé et métastatique.
Dans le cancer du sein triple négatif localisé, l’essai Keynote 5221 a évalué l’ajout du pembrolizumab à une chimiothérapie néo-adjuvante par quatre cures de Caboplatine-Paclitaxel suivies de quatre cures d’épirubicine-cyclophosphamide. Le pembrolizumab était ensuite poursuivi en post-opératoire pour une durée d’un an. L’intérêt du pembrolizumab en termes de taux de réponse histologique complète ou pCR était connu avec un taux de pCR de 64,8 % vs. 51,2 % (p=0,00055).
Au dernier congrès de l’ESMO, ont été présentés les résultats en termes de survie sans événement (rechute locale ou à distance) et l’intérêt du pembrolizumab s’est confirmé avec un taux de survie sans événement à 3 ans de 84,5 % dans le bras pembrolizumab versus 76,8 % dans le bras standard (HR 0,63, IC95 % 0,48-0,82, p=0,00031), ce qui en fait un futur standard dans le traitement néo-adjuvant et post-néoadjuvant des cancers du sein triple négatif.
Lors du congrès, ont également été présentés les résultats de l’essai Keynote-3552 évaluant l’ajout du pembrolizumab à une chimiothérapie standard par Taxane ou Carboplatine-Gemcitabine chez des patientes atteintes de cancer du sein triple négatif métastatique. Un gain en termes de survie sans progression notamment en cas de tumeurs fortement positive pour PD-L1 (ou score CPS >10) avait déjà été rapporté avec une survie sans progression médiane passant de 5,6 mois à 17,3 mois en cas de traitement par pembrolizumab.
Cette année, les résultats de la survie globale avec en cas de forte expression de PD-L1 (CPS >10) ont montré un très net avantage à l’ajout du pembrolizumab avec une survie médiane de 23 mois versus 16,1 mois (HR 0,73 (IC95 % 0,55-0,95, p=0,0093), positionnant également le pembrolizumab comme futur standard en première ligne, en association à la chimiothérapie, en cas de cancer du sein triple négatif métastatique avec un score CPS >10.
Références :
- P. Schmid, J. Cortes, R. Dent, L. Pusztai, H. McArthur, S. Kümmel, J. Bergh, C. Denkert, Y.H. Park, R. Hui, N. Harbeck, M. Takahashi, M. Untch, P.A. Fasching, F. Cardoso, Y. Ding, K. Tryfonidis, G. Aktan, V. Karantza, J. O’Shaughnessy. KEYNOTE-522: Phase 3 study of pembrolizumab + chemotherapy vs placebo + chemotherapy as neoadjuvant treatment, followed by pembrolizumab vs placebo as adjuvant treatment for early triple-negative breast cancer (TNBC). 17 Sep 2021
- H.S. Rugo, J. Cortés, D.W. Cescon, S. Im, M. Md Yusof, C. Gallardo, O. Lipatov, C.H. Barrios, J. Perez-Garcia, H. Iwata, N. Masuda, M. Torregroza Otero, E. Gokmen, S. Loi, Z. Guo, X. Zhou, V. Karantza, W. Pan, P. Schmid. KEYNOTE-355: Final results from a randomized, double-blind phase III study of first-line pembrolizumab + chemotherapy vs placebo + chemotherapy for metastatic TNBC. 19 Sep 2021
Essais précoces
Le DITEP publie son outil de prédiction du screen fail pour les candidats à une étude de phase I

Daphné Morel, Stéphane Champiat, Loïc Verlingue
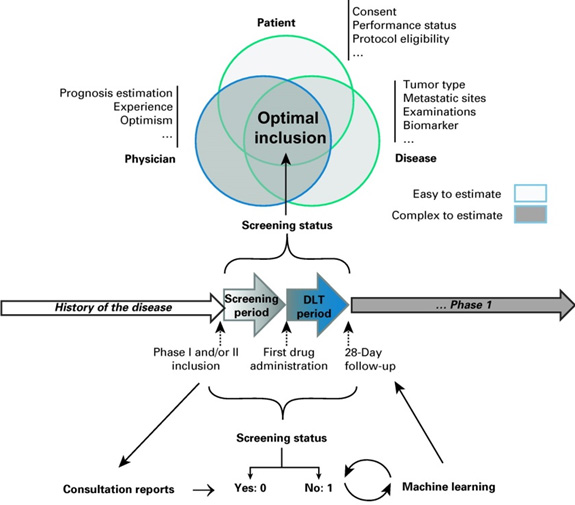
Environ 40 % des patients candidats à un essai clinique de phase I ne remplissent finalement pas les critères de sélection ou bien seront amenés à sortir précocement de l’essai, pour des raisons imprévisibles au moment de la signature du consentement. Grâce à son outil d’intelligence artificielle, le Département d'innovation thérapeutique et d'essais précoces de Gustave Roussy a pour objectif de réduire ce taux de screen fail à moins de 15 %.
Pour les patients souhaitant participer à une étude clinique, il y a une « étape d’entrée », appelée le screening, qui désigne la période pendant laquelle l’équipe clinique vérifie que le patient présente bien tous les critères pour recevoir le traitement. Entre 20 et 30 % des patients candidats de phase I sont habituellement screen fail (c’est-à-dire qu’ils ne valident pas tous les critères d’inclusion), et 10 % des patients passeront le screening mais seront non contributifs à l’essai (sortie d’essai précoce) et devront être remplacés.
Ces situations font perdre un temps précieux au patient et à l’équipe soignante, et peuvent, dans certains cas, entrainer un retard de prise en charge adaptée (soins palliatifs ?) et une perte de chance pour le patient. C’est pourquoi le DITEP a mis au point un outil d’intelligence artificielle qui prédit les chances de succès d’inclusion d’un patient, à partir du compte-rendu de consultation.
L’outil analyse le compte-rendu de consultation en texte libre généré lors de la consultation d’inclusion dans un essai clinique, et donne ensuite une prédiction binaire (0 ou 1) correspondant aux chances de succès de l’inclusion du patient dans l’essai. Sur une cohorte rétrospective indépendante de 264 patients ayant consulté au DITEP pour rentrer dans un essai, l’outil a obtenu une AUC de 88 %, et aurait pu faire tomber le taux de screen fail et sortie précoce de 39,8 % à 12,8 %. Le taux de faux positifs (patients qui auraient été faussement prédits screen fail) était de 8,7 %, ce qui est bien meilleur que les taux obtenus avec les scores type RMH.
La validation prospective et multicentrique de cet outil (non interventionnelle) est prévue courant 2022. Le design de cet essai a bénéficié du programme SPARK de Gustave Roussy, édition 2021.
Référence :
- Julie Delorme et al. Natural Language Processing for Patient Selection in Phase I or II Oncology Clinical Trials. JCO Clin Cancer Inform. 2021 Jun;5:709-718. doi: 10.1200/CCI.21.00003
Pathologie endocrine
Essai randomisé en double aveugle du sunitinib dans les phéochromocytomes et paragangliomes malins : résultats de l’étude internationale FIRSTMAPPP
Eric Baudin
L’étude académique FIRSTMAPPP est la première étude randomisée dans le domaine des phéochromocytomes et paragangliomes malins (PPM). FIRSTMAPPP montre, avec le niveau de preuve le plus élevé jamais atteint, le bénéfice antitumoral du sunitinib dans les PPM progressifs sur la base d’un gain de survie sans progression à un an.
Les PPM sont des tumeurs très rares (<1/106) pour lesquels il n’y a pas de standard thérapeutique validé. Cinq études de phases II ont été publiées à ce jour : deux concernent la radiothérapie interne vectorisée, deux, les inhibiteurs de tyrosine kinase et une, l’immunothérapie.
Nous rapportons ici les résultats de la 1re étude randomisée évaluant le sunitinib. Cette étude a inclus 78 patients (âge médian, 53 ans ; 59 % d'hommes) présentant dans 32 % des cas un PPM héréditaire, 71 % des cas un PPM sécrétant. 39 patients ont été randomisés dans chaque bras. Le critère d'évaluation principal a été atteint dans chaque bras : la PFS à 12 mois était de 35,9 % (sunitinib) contre 18,9 % (placebo) ; la PFS médiane était de 8,9 (95CI: 5,5-12,7) contre 3,6 mois (95CI: 3,1-6,1). Les raisons de l'arrêt du médicament étaient dues aux effets indésirables (14 % sunitinib et 0 % placebo) ou à la progression tumorale (64 % sunitinib et 86 % placebo).
Cette première étude randomisée dans le domaine des PPM démontre avec le niveau de preuve le plus élevé jamais atteint, le bénéfice du sunitinib. Le sunitinib devient alors l'option de première intention chez les patients atteints de PPM en progression.
La capacité de Gustave Roussy à mettre en place des études européennes académiques a été reconnue par des centres experts regroupés en réseau (INCa COMETE, ENSAT). La générosité des donateurs, les partenariats avec l’industrie pharmaceutique et la mise en place d’une recherche translationnelle ont été essentiels à la réussite de cette étude de plus de dix ans.
Référence :
-
E. Baudin et al. 567O_PR - First International Randomized STudy in MAlignant Progressive Pheochromocytoma and Paragangliomas (FIRSTMAPPP): an academic double-blind trial investigating Sunitinib. ESMO 2021
Pathologie thoracique
Dépistage du cancer du poumon en France : Interception-poumon en attendant Godot…
Pamela Abdayem
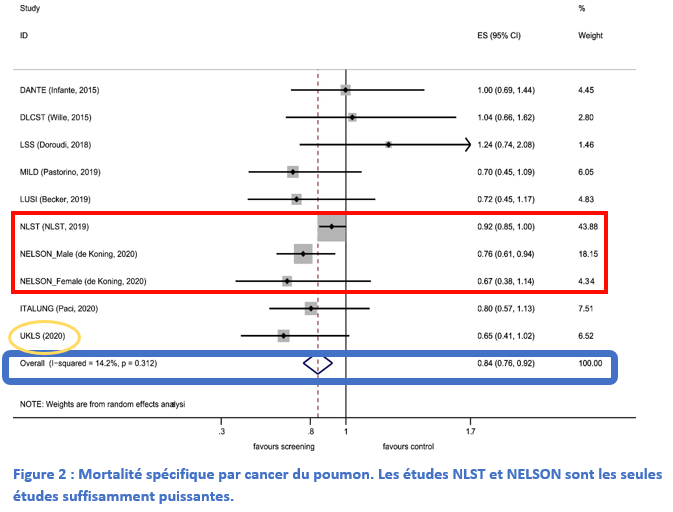
Le dépistage du cancer du poumon chez les personnes à risque permet de détecter la maladie à un stade précoce asymptomatique, potentiellement curable. Une méta-analyse récente, intégrant les résultats de neuf essais randomisés, a montré une réduction significative de 16 % de la mortalité par cancer bronchique grâce au dépistage par scanner thoracique basse-dose. Bien qu’il reste plusieurs problèmes à résoudre (intervalle entre scanners, standardisation de l’interprétation de l’imagerie, etc.), l’implémentation du dépistage du cancer bronchique en France est désormais indispensable.
Le cancer du poumon est le 2e cancer dans le monde en matière d’incidence et le 1er en matière de mortalité (données Globocan 2020). Le diagnostic se fait souvent à un stade avancé ce qui confère un pronostic sombre aux patients dont la survie à cinq ans est inférieure à 10 % pour les stades métastatiques. Le tabac reste le facteur de risque principal de cette maladie.
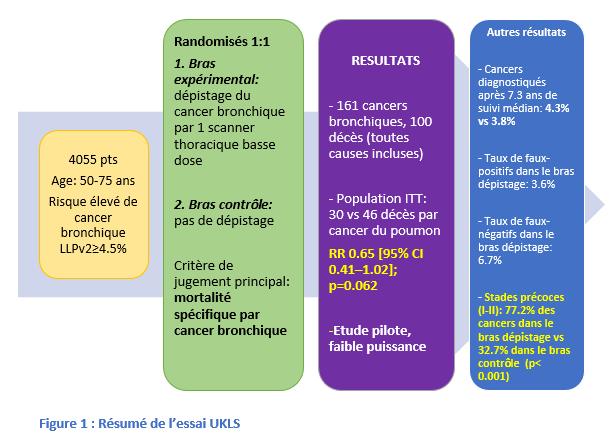
Le dépistage du cancer bronchique permet de détecter la maladie à un stade précoce asymptomatique accessible à un traitement curatif. Deux essais pivots, NLST et NESLON, ont montré une réduction significative de la mortalité (respectivement 20 % et 24 %) par cancer bronchique grâce au dépistage par scanner thoracique basse-dose non injecté chez les patients grands tabagiques (ou anciens grands tabagiques).
Une grande méta-analyse (comprenant 9 études randomisées) avec au moins 3 ans de suivi a démontré une réduction significative de 16 % de la mortalité par cancer du poumon grâce au dépistage (RR 0.84 ; 95 % CI 0.76-0.92 ; hétérogénéité non significative p= 0.31, I2=14.2 %). Une petite diminution relative de la mortalité globale a été observée (RR 0.97 [0.94–1.00] ; p=0.61, I2=0.0 %). Des études portant sur la personnalisation de l’intervalle de dépistage sont en cours.
Le dépistage organisé du cancer du poumon, désormais un standard dans beaucoup de pays, ne l’est toujours pas en France malgré les données de preuve solides récentes. Il figure néanmoins dans la stratégie décennale de lutte contre les cancers 2021-2030, dévoilée par le président de la République, en février 2021. En attendant, Gustave Roussy a lancé Interception, un programme innovant dont l’objectif est d’identifier et de dépister de manière personnalisée les personnes ayant un risque augmenté de développer certains cancers.
Chaque parcours du programme propose une journée de consultation, des ateliers informatifs et une évaluation nutritionnelle permettant ainsi aux participants d’avoir une bonne connaissance de leurs facteurs de risque et de leur proposer des pistes de dépistage personnalisées. De plus, Interception s’engage a assuré la prise en charge des participants en cas de découverte ou de survenue d’un cancer, en leur donnant accès aux thérapies les plus innovantes.
La journée Interception dédiée au cancer du poumon a lieu tous les mercredis et concerne les hommes et les femmes âgés de plus de 50 ans, grands tabagiques ou anciens grands tabagiques. Elle comprend des consultations individuelles, un atelier de sensibilisation en groupe aux méfaits du tabac et aux modalités de sevrage ainsi qu’un scanner thoracique basse-dose dont les résultats sont communiqués immédiatement aux participants avec orientation par la suite, si besoin.
Référence :
- J.K. Field et al., Lung cancer mortality reduction by LDCT screening: UKLS randomised trial results and international meta-analysis, The Lancet Regional Health - Europe (2021), doi.org/10.1016/j.lanepe.2021.100179
Gynéco-oncologie
Pembrolizumab plus chimiothérapie avec ou sans bevacizumab : un nouveau standard en première ligne de prise en charge des cancers du col de l’utérus métastatiques ou en rechute.
Maria Kfoury
L’étude KEYNOTE-826, présentée au congrès de l’ESMO 2021, a montré que le pembrolizumab associé à une chimiothérapie avec ou sans bevacizumab a entraîné une amélioration significative de la survie globale et de la survie sans progression chez les patientes atteintes d’un cancer du col de l’utérus persistant, en rechute ou métastatique.
La prise en charge du cancer du col repose, selon son extension, sur la chirurgie, la radiothérapie externe, la curiethérapie et la chimiothérapie, utilisées seules ou en association.
Bien que les cancers du col localisés et localement avancés puissent être guéris par une chirurgie radicale, une radiochimiothérapie ou les deux, les options sont limitées pour les patientes atteintes de cancer du col persistant ou en récidive après une radio-chimiothérapie ou d’emblée métastatique.
Le traitement standard de la prise en charge du cancer du col de l'utérus dans ces situations est la chimiothérapie à base de platine. Et l’ajout du bevacizumab est la seule option associée à la chimiothérapie à base de platine qui améliore la survie globale de 3,7 mois1.
Le pembrolizumab a montré une efficacité dans le cancer du col de l'utérus métastatique ou en rechute PD-L1 positif 2 avec des réponses en monothérapie parfois prolongées.
L’étude KEYNOTE-158 a évalué l’ajout du pembrolizumab à la chimiothérapie avec ou sans bevacizumab de 1re ligne des cancers du col de l’utérus persistants, en rechute ou métastatiques3 et un essai de phase III a récemment été présenté en virtual plenary à l’ESMO, démontrant la supériorité d’un anti-PD-1 (cemiplimab) à une chimiothérapie de seconde ligne.4
Dans l’essai KEYNOTE-826, les patientes étaient randomisées 1:1 en double aveugle pour recevoir toutes les 3 semaines, le pembrolizumab 200 mg ou placebo jusqu'à 35 cycles en plus de la chimiothérapie à base de platines et le bevacizumab 15 mg/kg à la discrétion de l'investigateur. Il y avait une stratification entre autre sur le score positif combiné (CPS) PD-L1 (<1 ;1-<10 ; ≥ 10).
Chez 548 patientes avec un CPS PD-L1 ≥ 1, la survie médiane sans progression a significativement augmenté, passant de 8,2 mois dans le groupe placebo à 10,4 mois dans le groupe pembrolizumab (HR à 0,62 ; IC95 %, 0,50 à 0,77 ; P < 0,001). La survie globale à 24 mois a également significativement augmenté passant de 41,7 % dans le groupe placebo à 53 % dans le groupe pembrolizumab (HR 0,64 ; IC 95 %, 0,50 à 0,81 ; P<0,001). Le bénéfice est également rapporté chez les patientes quel que soit leur statut PD-L1 et celles prétraitées par bevacizumab. Les événements indésirables correspondaient aux profils de toxicité connus.
Ces résultats ont conduit à l’approbation par les autorités sanitaires américaines (FDA) de l’adjonction du pembrolizumab à la chimiothérapie avec ou sans bevacizumab en première ligne chez les patientes avec un cancer du col persistant, récurrent ou métastatique avec un CPS ≥1 PD-L1. Gustave Roussy espère pouvoir y avoir accès rapidement pour ses patientes.
Références :
- Tewari KS, Sill MW, Long HJ, et al. Improved Survival with Bevacizumab in Advanced Cervical Cancer. N Engl J Med. 2014;370(8):734-743. doi:10.1056/NEJMoa1309748
- Chung HC, Ros W, Delord J-P, et al. Efficacy and Safety of Pembrolizumab in Previously Treated Advanced Cervical Cancer: Results From the Phase II KEYNOTE-158 Study. J Clin Oncol. 2019;37(17):1470-1478. doi:10.1200/JCO.18.01265
- Colombo N, Dubot C, Lorusso D, et al. Pembrolizumab for Persistent, Recurrent, or Metastatic Cervical Cancer. N Engl J Med. Published online September 18, 2021:NEJMoa2112435. doi:10.1056/NEJMoa2112435
- Tewari K et al. Empower - cervical 1-GOG 3016 ENGOTcx9: results of ph 3 trial of cemiplimab vs ionvestigator’s choice (IC) chemotherapy in recurrent/metastatic cervical cancer. ESMO virtual plenary
Abonnez-vous à la newsletter Good to Know
Ne manquez pas les prochains numéros de la newsletter Good to Know : abonnez-vous !
