
L'ACTUALITÉ EN CANCÉROLOGIE VUE PAR GUSTAVE ROUSSY
Newsletter #4 - janvier 2021
Sénologie
Un nouveau traitement dans le cancer du sein triple négatif métastatique

Anna Ilenko, Benjamin Verret
Le Sacituzumab Govitecan, premier anticorps conjugué anti-Trop2, démontre une efficacité majeure en termes de survie sans progression et survie globale dans le cancer du sein triple négatif métastatique au-delà de la première ligne.
Le Sacituzumab Govitecan est un anticorps anti-Trop2, protéine de surface largement exprimée dans plusieurs types de cancer, couplé à du SN-38, le métabolite actif de l’irinotecan (inhibiteur de la topoisomérase 1). L’essai de phase 1 suggérait déjà une efficacité importante dans le cancer du sein triple négatif avec un taux de réponse de 33 % et une survie sans progression médiane de 7,7 mois chez des patientes au-delà de la 2e ligne de traitement. A l’ESMO 2020 ont été présenté les résultats préliminaires de l’essai de phase 3 ASCENT évaluant le Sacizitumab Govitecan versus une chimiothérapie au choix de l’investigateur en 2e ligne et au-delà pour un cancer du sein triple négatif métastatique. 468 patientes ont participé à l’étude avec en médiane quatre précédentes lignes de traitements. Dans cette population lourdement pré-traitée, l’intérêt du Sacituzumab-Govitecan est confirmé avec une survie sans progression médiane de 5,6 mois vs 1,7 mois (HR 0.41, CI95 % (0,32-0,52)) mais également une survie globale médiane presque doublée à 12,1 mois vs 6,7 mois (HR 0.48, CI95 % (0,38-0,58)). Les principaux effets secondaires étaient la neutropénie et des diarrhées. Il est donc clair que le Sacituzumab Govitecan fera partie de l’arsenal thérapeutique du cancer du sein triple négatif et les études futures vont permettre d’évaluer son intérêt dans des lignes plus précoces ainsi qu’en néo-adjuvant, adjuvant et post-néo-adjuvant.
Références :
Bardia A et al. ASCENT : A randomized phase 3 study of sacituzumab govitecan (SG) vs treatment of physician’s choice (TPC) in patients (pts) with previously treated metastatic triple-negative breast cancer (mTNBC). ESMO Virtual Congress 2020, LBA17
Essais précoces
L'espoir d'une thérapie épigénétique pour soigner les sarcomes épithélioïdes
Daphné Morel, Stéphane Champiat, Loïc Verlingue
Le tazemetostat (inhibiteur d’EZH2) est un médicament en cours d’évaluation clinique qui a montré une activité anti-tumorale lors d’études de phase I dans certaines tumeurs présentant une anomalie épigénétique. D’après cette nouvelle étude de phase II, les sarcomes épithélioïdes feraient partie des bons candidats à ce type d’approche.
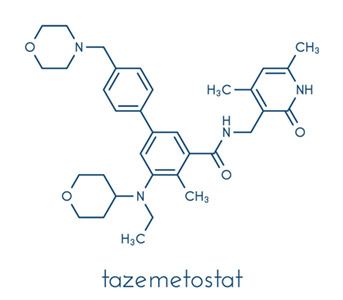
Des anomalies épigénétiques (anomalies impactant l’expression des gènes sans en modifier l’ADN) sont fréquemment retrouvées lorsqu’on étudie le génome des cancers. Dans certains types de tumeurs, une anomalie épigénétique est même l’évènement déclencheur du processus de carcinogénèse. C’est le cas des sarcomes épithélioïdes, dont la perte de SMARCB1 caractérise environ 90 % des cas.
Le sarcome épithélioïde est une forme rare de sarcome des tissus mous, qui prend la forme d’une masse apparaissant généralement sur les doigts, les mains, les avant-bras ou les pieds, et qui touche essentiellement les adultes jeunes. D’un point de vue moléculaire, la perte de SMARCB1 engendre « l’activation oncogénique » d’EZH2, une enzyme épigénétique qui va favoriser le développement du cancer.
Dans cette étude clinique de phase II, 62 patients atteints d’un sarcome épithélioïde avancé ou métastatique avec perte d’expression et/ou mutation génétique de SMARCB1 ont reçu du tazemetostat (inhibiteur d’EZH2) en monothérapie, par voie orale. Au moment de l’arrêt du suivi : neuf patients (15 %) avaient présenté une réponse partielle et 13 (21 %) patients n’avaient pas progressé après un an de traitement. Peu d’effets secondaires ont été observés – principalement de la fatigue, des nausées/vomissements de bas grade, et une perte d’appétit.
Ces données suggèrent d’une part que le tazemetostat présente un intérêt à être utilisé en tant qu’anti-tumoral dans ce type de tumeur et d’autre part, que son profil de tolérance devrait permettre de l’associer à d’autres traitements sans majorer les effets secondaires. C’est d’ailleurs le cas dans une nouvelle étude de phase Ib/III, qui étudie la combinaison du tazemetostat et de la doxorubicine en première ligne de traitement chez ces patients. L’essai, randomisé versus doxorubicine plus placebo, devrait permettre de juger de la valeur ajoutée du tazemetostat dans cette indication.
Références :
Tazemetostat in advanced epithelioid sarcoma with loss of INI1/SMARCB1: an international, open-label, phase 2 basket study. Gounder M. et al. Lancet Oncol. 2020 Nov;21(11):1423-1432.
Essais précoces / Recherche
Analyse moléculaire : la clé pour mieux traiter les cholangiocarcinomes avec remaniement de FGFR2
Francesco Facchinetti
Le cholangiocarcinome (CCA) est un cancer des voies biliaires caractérisé par une agressivité clinique et un manque de traitements efficaces. La connaissance des altérations génomiques qui entrainent la genèse et la croissance des CCA permet de développer des thérapies ciblées. Les remaniements du gène FGFR2 représentent le meilleur exemple de cible thérapeutique dans les CCA.
Dans l’étude de phase 2 FIGHT-202, 1 206 malades atteints d’un CCA ont été dépistés au niveau moléculaire avec les analyses de Next Generation Sequencing de FoundationOne®. L’étude a révélé que les patients avec remaniement de FGFR2 (n = 107) bénéficient d’un traitement avec pemigatinib, inhibiteur tyrosine kinase sélectif de FGFR. Les taux de réponses objectives et de contrôle de maladie étaient de 35 % et 82 %, respectivement, avec 6,9 mois de survie médiane sans progression.1 Grâce à ces résultats, le pemigatinib a été approuvé aux États-Unis pour cette indication précise.
Les investigateurs, parmi lesquels figurent le Dr Antoine Hollebecque, oncologue médicale du Ditep et du comité digestif de Gustave Roussy, et le Dr Luc Friboulet, chef d’équipe de recherche à l’unité INSERM U981, ont proposé des analyses moléculaires détaillées dans une étude récemment publiée dans Cancer Discovery.2 A la différence d’autres remaniements (comme pour ceux des gènes ALK ou ROS1 dans le cancer du poumon), les gènes partenaires de FGFR2 dans les CCA sont très divers. Le gène partenaire était BICC1 chez 28 % des malades, mais dans 33 % des cas le gène partenaire était unique pour chaque patient. Le type de gène partenaire de FGFR2 (BICC1 vs autres) ne conditionne pas l’action de pemigatinib.
En association au remaniement de FGFR2, 38 % des malades présentaient une mutation de BAP1. Comme le nombre de malades limite les comparaisons statistiques, on ne peut pas déterminer avec certitude l’effet de l’inactivation de ce gène suppresseur de tumeur sur l’activité de pemigatinib.
Chez huit malades, des analyses moléculaires ont aussi été effectuées sur une biopsie tumorale en progression, après avoir répondu au traitement (résistance acquise). Tous les malades présentaient au moins une mutation du domaine tyrosine kinase de FGFR2, empêchant l’accès au pemigatinib à son site actif. Pour trois de ces huit cas, il a été observé une « résistance poly-clonale », puisque de multiples mutations ont été détectées à la progression.
Références :
1. Abou-Alfa GK, Sahai V, Hollebecque A, Vaccaro G, Melisi D, Al-Rajabi R et al. Pemigatinib for previously treated, locally advanced or metastatic cholangiocarcinoma: a multicentre, open-label, phase 2 study. Lancet Oncol. 2020 May;21(5):671-684. doi: 10.1016/S1470-2045(20)30109-1.
2. Silverman IM, Hollebecque A, Friboulet L, Owens S, Newton RC, Zhen H, Feliz L, Zecchetto C, Melisi D, Burn TC. Clinicogenomic analysis of FGFR2-rearranged cholangiocarcinoma identifies correlates of response and mechanisms of resistance to pemigatinib. Cancer Discov. 2020 Nov 20:CD-20-0766. doi: 10.1158/2159-8290.CD-20-0766. Online ahead of print.
Recherche
Rôle de l’H2O2 produit par la NADPH oxydase DUOX1 dans la fibrose pulmonaire induite par les traitements anti-cancéreux
Corinne Dupuy
De par le peroxyde d’hydrogène (H2O2) qu’elle produit, l’enzyme NADPH-oxydase DUOX1 contribue au maintien de l’activation de la voie de signalisation du facteur de croissance TGF-β1 dans les fibroblastes et favorise le recrutement pulmonaire des neutrophiles, l’ensemble participant au développement de la fibrose pulmonaire.
La fibrose pulmonaire est une pathologie caractérisée par l'activation interstitielle des fibroblastes pulmonaires couplée à la production de matrice extracellulaire, conduisant à une destruction de l’architecture pulmonaire et, de manière ultime, à une diminution de la fonction respiratoire. Elle peut se développer suite à une agression (irradiation, traitement anti-cancéreux) ou demeurer idiopathique. Elle est le résultat d’une activité aberrante des cellules épithéliales alvéolaires, qui provoque une migration, une prolifération et une accumulation excessives des fibroblastes qui forment des foyers fibroblastiques, ce qui entraîne un dépôt excessif de matrice extracellulaire. Ces phénomènes sont régis par le facteur de croissance TGF-β1, notamment via la voie de signalisation cellulaire SMAD.
Un nombre croissant d’études révèle le rôle du stress oxydant chronique, couplé à la voie de signalisation du facteur de croissance TGF-β1, dans la progression de la fibrose. Les espèces réactives de l’oxygène (ERO) ainsi que d’autres marqueurs de stress oxydant sont élevés dans la fibrose pulmonaire. De plus, le niveau d’ERO, qui corrèle négativement avec la fonction pulmonaire, peut prédire le degré de sévérité de la maladie. Les ERO peuvent être produits par les cellules grâce à l’activation et/ou l’induction des enzymes NADPH-oxydases. Ces protéines membranaires constituent une famille d’enzymes comportant notamment deux dual-oxydases DUOX1 et 2 impliquées dans la fonction thyroïdienne et dans la défense et l’inflammation des voies aériennes. L’enzyme DUOX1, en tant que système extracellulaire générateur de H2O2, est impliquée dans la formation de la matrice extracellulaire et dans la cicatrisation des plaies dans différents modèles expérimentaux. C’est pourquoi l’étude réalisée émet l’hypothèse que la NADPH-oxydase DUOX1 joue un rôle majeur dans la physiopathologie de la fibrose pulmonaire.
La dual-oxydase (DUOX1) génère de l’H2O2 à la surface des cellules. Les données de l’étude in vivo (modèle murin de fibrose pulmonaire) montrent que l’expression de l’enzyme NADPH oxydase DUOX1 est induite dans le tissu fibreux (Fig. 1), plus précisément dans les cellules épithéliales et dans les foyers myo-fibroblastiques, en réponse à une lésion pulmonaire.
L’étude montre également que les modèles murins déficients en DUOX1 (DUOX1+/- et DUOX1-/-) développent moins de cas de fibrose pulmonaire expérimentale induite par l’irradiation (coll. Lydia Meziani & Eric Deutsch) ou par l’instillation trachéale de bléomycine, un agent anti-cancéreux. L’analyse du mécanisme a révélé que DUOX1, via l’H2O2 qu’elle produit, amplifie et maintient l’activation de la voie de signalisation du facteur de croissance transformant TGF- β1, ayant pour conséquence une activation chronique des fibroblastes et le développement de la fibrose (Fig. 2). De plus, l’inactivation de DUOX1 diminue significativement le recrutement pulmonaire des neutrophiles associé à la fibrose.
L’enzyme NADPH-oxydase DUOX1 deviendrait donc une cible thérapeutique de la fibrose pulmonaire induite par les traitements anti-cancéreux.
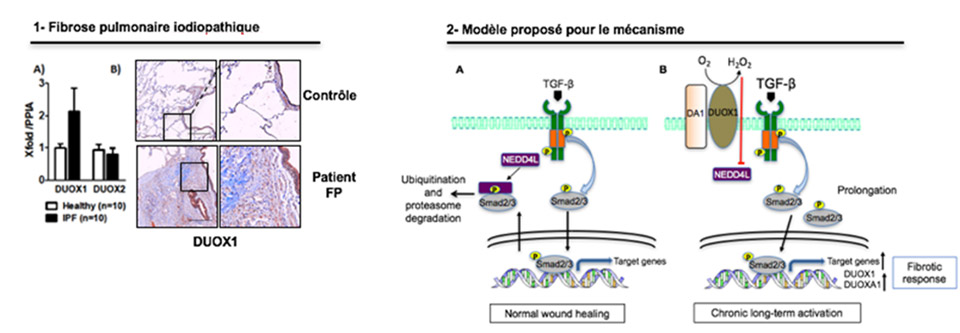
Figures :
- DUOX1 est induite dans le tissu fibreux (A : qPCR, B : IHC) –
- Mécanisme proposé : en condition normale de cicatrisation (A) les fibroblastes sont activés de manière transitoire. L’ubiquitine ligase NEDD4L cible la forme phosphorylée de Smad3 pour la destruction, restreignant la durée de la réponse au TGF-β1.
Lors d’une activation chronique, l’expression de DUOX1 est augmentée et l’H2O2 qu’elle produit inhibe l’interaction entre NEDD4L et phospho-Smad3, contribuant ainsi à la prolongation de l’activation de la voie du TGF-β1 et, par conséquent, à une augmentation de la translocation de phospho-Smad3 dans le noyau où il fonctionne en tant que facteur de transcription régulant l’expression de gènes impliqués dans la progression de la fibrose.
Références :
Louzada RA, Corre R, Ameziane El Hassani R, Meziani L, Jaillet M, Cazes A, Crestani B, Deutsch E & Dupuy C. NADPH oxidase DUOX1 sustains TGF-β1 signalling and promotes lung fibrosis.
Published online August 6, 2020. doi: 10.1183/13993003.01949-2019.
Recherche
La plupart des composés cancérigènes ne sont pas mutagènes

Filippo Rosselli
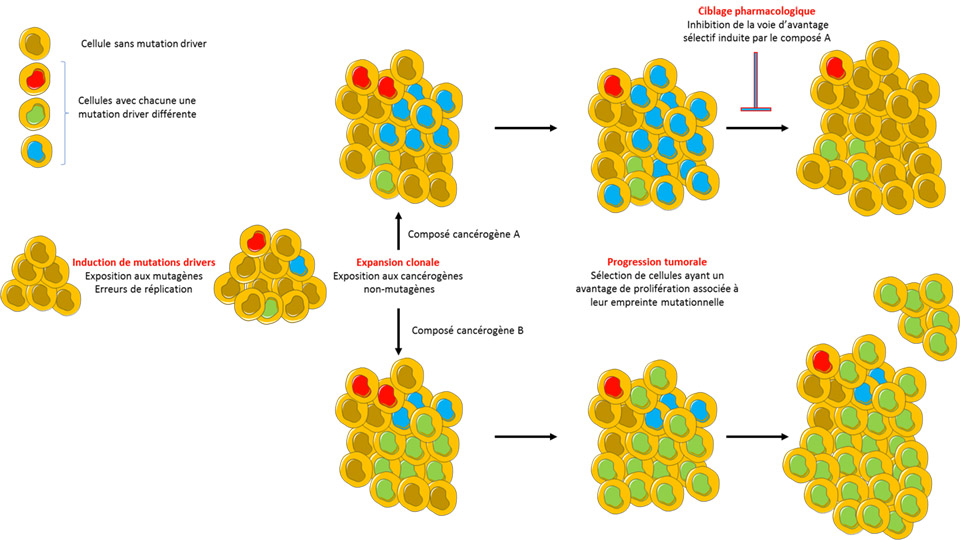
On considère que l’exposition à des cancérogènes est responsable de l’induction de mutations dans le génome cellulaire qui, de manière coopérative, bouleversent le programme génétique de la cellule et permettent l'initiation et la progression tumorale. A contrario de cette hypothèse simple et linéaire, il a été récemment montré que la présence de mutations affectant les oncogènes et les suppresseurs de tumeurs dans les tissus « sains » était plutôt la règle que l'exception.
De toute évidence, si des mutations sont nécessaires, le développement du cancer nécessite d'autres contributions. L'article publié par Riva et al dans le numéro de novembre de Nature Genetics fournit de nouvelles perspectives. Les auteurs ont testé vingt molécules cancérogènes connues dans un modèle de souris, notant que l’exposition à la très large majorité de ces molécules (17/20) n’était pas liée à des signatures mutationnelles spécifiques dans les tumeurs induites chez les souris, n’augmentait pas la charge mutationnelle de ces tumeurs et ne provoquait pas des mutations oncogéniques « drivers », ces dernières étant presque toujours liées à des processus mutationnels endogènes des cellules.
Ces résultats suggèrent que la plupart des molécules carcinogènes connues permettent l'émergence de cellules ayant déjà des mutations oncogènes drivers endogènes. Cela soulève la question de savoir comment un cancérogène non-mutagène permet alors la progression tumorale. Même si la réponse n'a pas encore été donnée, et au-delà de la simple idée qu’ils promeuvent un processus darwinien de sélection de cellules ayant un avantage prolifératif, les résultats obtenus soulignent l'importance de définir la dynamique évolutive des tumeurs afin d'identifier les voies intracellulaires qui confèrent aux cellules mutées un avantage sélectif au sein des tissus. Identifier de telles voies pourrait représenter des nouvelles approches thérapeutiques par létalité synthétique par exemple.
Cibler les mécanismes qui permettent aux cellules tumorales d'émerger et de rester dans leur environnement pourrait être une approche plus puissante qu’inhiber des voies biochimiques ou moléculaires potentiellement redondantes avec celles mutées dans le cancer, et pourrait possiblement empêcher l'émergence de résistances.
Référence :
Riva et al. The mutational signature profile of known and suspected human carcinogens in mice. Nature genetics, 52, 1189-1197, novembre 2020.
Hématologie
« Shape les CHIP »
Jean-Baptiste Micol
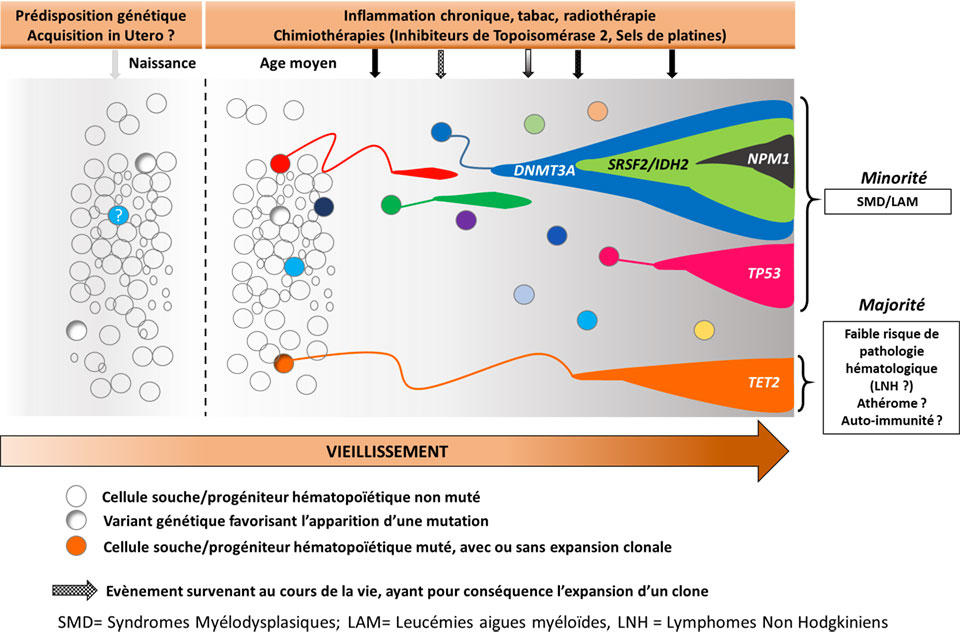
L’acronyme CHIP (Clonal hematopoiesis of indeterminate potential) décrit l’identification de mutations acquises dans les cellules sanguines de sujets sans maladie hématologique. L’incidence des CHIP augmente avec l’âge, le tabac et l’exposition à la chimiothérapie/radiothérapie et sont prédictives d’un risque accrue d’hémopathies malignes, de complications cardiovasculaires et de mortalité1.
Deux études récentes décrivent les facteurs associés à l’apparition des CHIP.
Une étude du National Heart, Lung, and Blood Institute américain2 sur 97 691 séquençages de génome humain entier, publiée dans Nature en octobre 2020, a permis l’identification de 42 229 individus porteurs de CHIP, et d’étudier leur corrélation avec la présence de variants génétiques constitutionnels. Plusieurs loci génétiques ont été ainsi identifiés comme favorisant avec la présence de CHIP, notamment sur les gènes TERT, une région chevauchant les gènes KPNA4 and TRIM59 et une région inter-génique du gène TET2. Ce dernier est un des gènes majeurs de l’hématopoïèse, et les auteurs montrent ici que le variant identifié entraine in vitro et in silico une diminution de son expression pouvant expliquer l’émergence de CHIP.
Un autre travail du Memorial Sloan Kettering à New York3 portant sur 24 146 patients précise que seuls certains traitements comme la radiothérapie, l’utilisation de radionucléides ou certaines classes de chimiothérapies (inhibiteurs de topoisomérase 2, sels de platines) peuvent entrainer l’émergence des CHIP, principalement des CHIP impliquant des gènes de la réparation de l’ADN (PPM1D/CHEK2/TP53). D’autre part ils précisent que le risque d’hémopathie myéloïde induite (« therapy related ») n’est dû qu’à certaines CHIP affectant les gènes TP53 ou des gènes du spliceosome (SF3B1, U2AF1, SRSF2).
Les auteurs ont modélisé le risque d’apparition d’hémopathie myéloïde induite (sur des paramètres d’âge, d’existence de CHIP et d’anomalies de la numération) en fonction ou non de l’utilisation d’une chimiothérapie adjuvante dans le cadre du traitement du cancer du sein. Ils évaluent que pour 96 % des patientes de 50 à 75 ans le risque d’apparition à 10 ans d’hémopathie myéloïde induite est inférieur à 1 %. A l’inverse, pour une petite fraction de ces patientes (1 %) ce risque s’élèverait à 9 %. L’identification d’une population à risque par la biologie moléculaire pourrait donc permettre de personnaliser l’adjonction ou non de chimiothérapie adjuvante en identifiant les patientes chez qui le bénéfice attendu sur le pronostic du cancer du sein serait inférieur au risque encouru d’hémopathie induite.
Ces données, bien qu’encore difficilement transposables en clinique, constituent une avancée vers une médecine personnalisée moléculaire préventive, par l’identification des patients à risque de CHIP et donc possiblement d’émergence d’hémopathie induite.
Références :
- Danlos FX, Papo M, Micol JB. L’hématopoïèse clonale : un concept émergent à la croisée des spécialités [Clonal haematopoiesis: A concise review]. Rev Med Interne. 2019 Oct;40(10):684-692. French. doi: 10.1016/j.revmed.2019.05.005. Epub 2019 May 22. PMID: 31126662.
- Bick, A.G., Weinstock, J.S., Nandakumar, S.K. et al. Inherited causes of clonal haematopoiesis in 97,691 whole genomes. Nature 586, 763–768 (2020). doi : 10.1038/s41586-020-2819-2
- Bolton, K.L., Ptashkin, R.N., Gao, T. et al. Cancer therapy shapes the fitness landscape of clonal hematopoiesis. Nat Genet 52, 1219–1226 (2020). doi : 10.1038/s41588-020-00710-0
Recherche / Hématologie
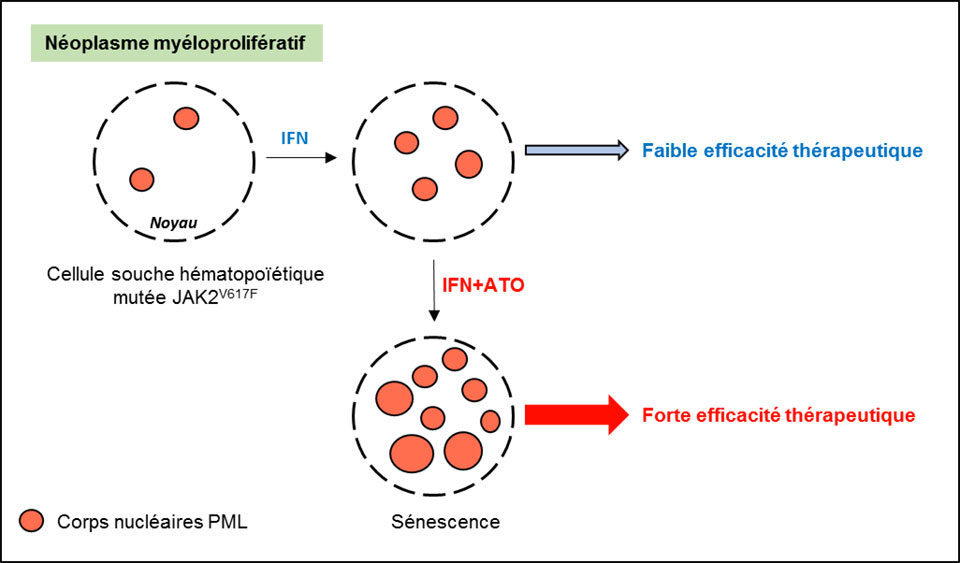
La combinaison IFN/Arsenic est efficace dans les néoplasmes myéloprolifératifs
Ileana Antony-Debré, Aline Renneville, Lucie Laplane, Isabelle Plo
Les néoplasmes myéloprolifératifs (NMP) sont des hémopathies malignes chroniques conduisant à une surproduction de cellules myéloïdes matures dans le sang. L’interféron α (IFN-α) est utilisé pour traiter ces maladies et permet d’obtenir des rémissions, mais n’est pas toujours suffisant pour éradiquer la maladie. Pour améliorer l’efficacité de ce traitement, l’équipe de Jean-Luc Villeval et Isabelle Plo de l’Unité Inserm U1287 à Gustave Roussy, en collaboration avec celles d’Hugues de Thé (Collège de France), et de Jean-Jacques Kiladjian (Hôpital St Louis) ont exploré le rôle d’une cible de l'interféron, la protéine PML (promyelocytic leukemia). PML est impliqué dans la formation des corps nucléaires PML, des structures multiprotéiques qui régulent de nombreuses fonctions cellulaires telles que la sénescence (une forme de vieillissement cellulaire qui induit l’arrêt définitif de la prolifération). Sachant que l’induction de la formation de ces structures par le trioxyde d’arsenic (ATO) permet la guérison de la leucémie aiguë promyélocytaire, les auteurs ont fait l’hypothèse que l’association de l’ATO à IFN-α permettrait un traitement plus efficace des NMP.
Les résultats montrent que l'ATO potentialise bien la suppression de la prolifération cellulaire induite par l’IFN-α sur les cellules malignes/mutées de patients et de souris, avec une toxicité moindre sur les cellules normales. La combinaison de l'ATO avec l’IFN-α améliore et accélère la réponse dans un modèle murin de NMP, avec une éradication des cellules mutées dans la plupart des souris. L’étude apporte également la démonstration que cette efficacité thérapeutique est médié par la protéine PML.
Ces travaux ont une double importance: clinique, car ils ouvrent la voie à de nouvelles stratégies thérapeutiques pour potentialiser les effets limités de l’IFN-α en monothérapie, et fondamentale, par l’identification des mécanismes biologiques impliqués dans la réponse au traitement.
Références :
Dagher T*, Maslah N*, Edmond V*, Cassinat B, Vainchenker W, Giraudier S, Pasquier F, Verger E, Niwa-Kawakita M, Lallemand-Breitenbach V, Plo I, Kiladjian JJ*, Villeval JL*, de Thé H*. JAK2V617F myeloproliferative neoplasm eradication by a novel interferon/arsenic therapy involves PML. J Exp Med. 2021 Feb 1;218(2):e20201268. doi: 10.1084/jem.20201268.
*co-authorship
Patent : Methods and pharmaceutical compositions for the treatment patients suffering from myeloproliferative disorders. 2018, EP 17305053.5, US20190374611A1
Tumeurs neuroendocrines
Le retour des anti-angiogéniques dans la prise en charge des tumeurs neuroendocrines.
Comité des tumeurs endocrines
Neuf ans après les premières données randomisées de phase III ayant permis au sunitinib d’obtenir l’AMM dans les tumeurs neuroendocrines (TNE) pancréatiques (1), deux études randomisées contre placebo publiées conjointement dans le Lancet Oncology apportent des données d’efficacité du surufatinib, un inhibiteur multikinase à activité anti-angiogénique, contre placebo, dans les TNE bien différenciées pancréatiques (2) et extra-pancréatiques (3).
Les tumeurs neuroendocrines sont caractérisées par une angiogenèse qui est d’autant plus importante qu’elles sont bien différenciées, en particulier au niveau pancréatique, ce qui constitue un rationnel pour les traitements anti-angiogéniques.
Le surufatinib est un inhibiteur multikinase à activité anti-VEGFR1, VEGFR2, VEGFR3, FGFR1 et CSF1R développé par Hutchinson Medipharma, une compagnie pharmaceutique chinoise.
Son activité clinique a été étudiée dans deux phases III randomisées en double aveugle contre placebo, menées en Chine, portants sur 172 patients atteints de tumeurs neuroendocrines (TNE) bien différenciées du pancréas (étude SANET-p) et 198 patients atteints de TNE bien différenciées de toutes origines hors pancréas (étude SANTE-ep). Il s’agissait de patients en bon état général (ECOG 0-1), porteurs de TNE de grade 1-2 (Ki67 ≤20 %) avec maladie ayant progressé dans l’année précédant l’inclusion. Les deux études ont été interrompues lors de l’analyse intermédiaire pour efficacité avec une survie sans progression médiane (évaluée localement) de 10,9 mois contre 3,7 mois pour les patients avec TNE pancréatique (Hazard ratio (HR) à 0,49, 95 % CI 0,32–0,76; p=0·0011) et de 9,2 mois contre 3,8 mois pour les patients avec TNE extra pancréatique (HR 0,33; 95% CI 0,22–0,50; p<0·0001), en faveur du surufatinib. Dans l’étude SANET-p, le taux de réponse partielle confirmée en centralisé était de 14 % et le taux de stabilisation était de 70 %. Dans l’étude SANET-ep le taux de réponse partielle était de 8 % et le taux de stabilité de 70 %. L’hypertension était la toxicité de grade 3 la plus fréquente (36 %), 39 à 48 % des patients ont eu besoin d’une réduction de dose et environ 15 % des patients ont arrêté le traitement pour toxicité dans les deux études. Il n’y avait pas de syndrome mains-pieds rapportés.
Ces résultats confirment l’intérêt des anti-angiogéniques pour le traitement des tumeurs neuroendocrines bien différenciées métastatiques et, en particulier, apportent les premières données randomisées de cette stratégie dans les TNE non pancréatiques digestives et pulmonaires. Il faut noter toutefois une proportion importante de TNE du rectum (29 %) et assez faible de grêle (8 %) dans l’étude SANET-ep en comparaison aux autres études randomisées dans les TNE extra-pancréatiques. Une étude de phase I/II a suggéré une tolérance et une efficacité équivalentes dans une population américaine. Une étude de phase II en Europe, à laquelle Gustave Roussy participe, est également en cours pour confirmer ces données en population caucasienne.
Par ailleurs, les résultats de l’étude de phase III randomisée AXINET ayant comparé l’axitinib en association aux analogues de la somatostatine au placebo dans cette population de TNE extra pancréatique sont attendues prochainement et pourraient confirmer l’intérêt de cette stratégie dans cette population de patients. Enfin la place du surfatinib dans l’arsenal thérapeutique des TNE du pancréas reste à définir face au sunitinib qui avait montré un bénéfice équivalent contre placebo. On attend également les résultats des études d’association anti-angiogéniques et anti-PD1.
Les études SANET du surfatinib ouvrent donc la voie vers l’utilisation des anti-angiogéniques chez les patients atteints de TNE non pancréatiques et annoncent un regain d’intérêt de cette stratégie de ciblage du VEGF pour ces patients.
Références :
1. Raymond E, Dahan L, Raoul J-L, Bang Y-J, Borbath I, Lombard-Bohas C, et al. Sunitinib malate for the treatment of pancreatic neuroendocrine tumors. N Engl J Med. 10 févr 2011;364(6):501‑13.
2. Xu J, Shen L, Bai C, Wang W, Li J, Yu X, et al. Surufatinib in advanced pancreatic neuroendocrine tumours (SANET-p): a randomised, double-blind, placebo-controlled, phase 3 study. Lancet Oncol. nov 2020;21(11):1489‑99.
3. Xu J, Shen L, Zhou Z, Li J, Bai C, Chi Y, et al. Surufatinib in advanced extrapancreatic neuroendocrine tumours (SANET-ep): a randomised, double-blind, placebo-controlled, phase 3 study. Lancet Oncol. nov 2020;21(11):1500‑12.
Covid-19
La cohorte prospective Covid-ICU et la réanimation de Gustave Roussy

Annabelle Stoclin
La cohorte prospective Covid-ICU décrit les caractéristiques cliniques et l’évolution de 4 224 patients admis dans 149 réanimations pour détresse respiratoire « Covid » lors de la 1re vague. La mortalité, à J90, est de 31 %. A Gustave Roussy, 10 des 33 patients hospitalisés en réanimation entre fin mars et fin avril 2020 sont décédés (30 %).
149 réanimations françaises, belges et suisses ont participé à la cohorte prospective Covid-ICU promue par l’APHP. Les caractéristiques cliniques et l’évolution des patients ont été publiées fin octobre.
Du 25 février au 4 mai, 4 244 patients (âge médian : 63 ans) ont été admis en réanimation pour détresse respiratoire « Covid » : 74 % d’hommes, 41 % obèses, 48 % connus hypertendus et 28 % diabétiques. Les patients de Gustave Roussy ont été inclus.
80 % des patients ont été intubés. Curares et décubitus ventral ont été utilisés chez 88 % et 70 % des patients intubés à J1. 28 % ont été dialysés. Les durées médianes de ventilation invasive, de séjour en réanimation et à l’hôpital étaient respectivement de 13, 21 et 30 jours chez les patients vivants à J+90.
La mortalité, de 31 % à J+90, augmentait avec la gravité de la défaillance respiratoire (SDRA) : 30%, 34 %, et 50 % chez les SDRA de gravité faible, moyenne et sévère. Les durées de séjour, bien plus longues que celles observées chez des patients de même gravité ayant un SDRA « non-Covid », expliquent la mise en tension des services.
Parmi les 33 patients hospitalisés en réanimation à Gustave Roussy lors de la 1re vague, 23 ont été ventilés (dont 17 sans cancer) et 10 patients ayant un cancer ont reçus de l’oxygène à haut débit. 10 patients sont décédés (30 %) dont 8 ventilés : 5 patients sans cancer et 3 ayant un cancer. 2 patients, non ventilés de façon invasive du fait de leur état général, sont décédés.
Lors de la 2e vague, 13 patients ayant un cancer ont été hospitalisé dans notre réanimation. 5 sont décédés (38%): 3 ventilés et 2 patients que nous avions collégialement décidé de ne pas intuber du fait de leur état général.
Un suivi à long terme est nécessaire pour connaître le pronostic et les séquelles des formes sévères.
Malgré une intense recherche clinique il n’y a pas de médicament efficace contre ce virus : les vaccins sont donc attendus avec impatience.
Références :
1. COVID-ICU Group on behalf of the REVA Network and the COVID-ICU Investigators. Clinical characteristics and day-90 outcomes of 4244 critically ill adults with COVID-19: a prospective cohort study. Intensive Care Med. 2020 Oct 29:1-14.
2. Boilève A, Stoclin A, Barlesi F, Varin F, Suria S, Rieutord A, Blot F, Netzer F, Scotté F. COVID-19 management in a cancer center: the ICU storm. Support Care Cancer 28, 5037–5044 (2020).
Quiz
Avez-vous bien lu ce quatrième numéro de la newsletter Good to Know ?
Abonnez-vous à la newsletter Good to Know
Ne manquez pas les prochains numéros de la newsletter Good to Know : abonnez-vous !
Crédits photos : Adobe Stock, Gustave Roussy.
