
L'ACTUALITÉ EN CANCÉROLOGIE VUE PAR GUSTAVE ROUSSY
Newsletter #6 - mars 2021
Gynécologie
Inhibiteurs de PARP et risque d’hémopathies malignes secondaires
Alexandra Leary
Les inhibiteurs de PARP ont apporté la preuve de concept qu’il était possible de cibler les défauts de réparation de l’ADN à des fins thérapeutiques. Cette approche a démontré une efficacité dans plusieurs pathologies comme les cancers du sein, de la prostate, du pancréas ou de l’ovaire, particulièrement en cas de mutation délétère des gènes BRCA1 ou BRCA2. Leurs principales toxicités sont hématologiques, rapportées dans les trois premiers mois et sont facilement réversibles avec une interruption ou une diminution de la dose du traitement. De rares cas d’hémopathies malignes (HM) secondaires ont été rapportés chez des patients traités par des inhibiteurs de PARP, mais d’autres facteurs confondants, tels que de multiples lignes de chimiothérapies antérieures, ne permettaient pas d’évaluer la contribution de l’inhibiteur de PARP.
Des chercheurs de Caen et de Gustave Roussy ont pour la première fois démontré que les inhibiteurs de PARP étaient associés à un sur-risque de syndrome myélodysplasique ou de leucémie myéloïde aigue. Dans une méta-analyse conduite sur 18 essais randomisés contrôlés par placebo, le risque d’HM secondaire était significativement plus élevé dans le bras expérimental que placebo (HR=2,63 ; p=0,026). De manière rassurante, le taux d’incidence reste faible à moins de 1 %, et le risque ne semble pas significativement augmenté en cas de mutations BRCA1/2 constitutionnelles.
Les auteurs ont également fait une extraction de la base de données de pharmacovigilance de l’OMS (Vigibase) et identifié 178 cas d’HM associées à un traitement par inhibiteur de PARP. La période de latence médiane entre initiation du traitement et HM secondaire était courte, à 18 mois (par rapport à 5 ou 6 ans pour les HM secondaires associées aux cytotoxiques classiques). Avec < 6 mois de suivi, 45 % des patients avec une HM secondaire étaient décédés.
Implications : les iPARP sont associés à un léger sur-risque d’HM secondaire particulièrement agressive. Une surveillance rapprochée et un avis spécialisé en cas de toxicités hématologiques persistantes sont recommandés surtout au vu des récentes indications des iPARP en 1re ligne quand l’objectif est potentiellement curatif.
Référence :
Morice P-M, Leary A, Dolladille C, et. al.: Myelodysplastic syndrome and acute myeloid leukaemia in patients treated with PARP inhibitors: a safety meta-analysis of randomised controlled trials and a retrospective study of the WHO pharmacovigilance database. Lancet Haematol. Feb 2021. doi : 10.1016/S2352-3026(20)30360-4
Sénologie
Le bénéfice de la chimiothérapie des cancers du sein RH+/HER2 négatif, avec atteinte ganglionnaire, dépend du statut ménopausique : résultats de l’étude RxPonder
Anna Ilenko, Benjamin Verret
Le score de récurrence est basé sur l’étude de 21 gènes tumoraux dans le cancer du sein (récepteurs hormonaux positifs, HER2 négatif). L’étude TAILORx (2018) a montré qu’en cas de score de récurrence faible, le bénéfice de la chimiothérapie était bas, sans atteinte ganglionnaire. L’étude RxPonder, dans la continuité de TAILORx, a évalué le bénéfice de la chimiothérapie dans le même type de cancer du sein, mais avec atteinte ganglionnaire.
Le score de récurrence (RS) permet de prédire le potentiel de récidive du cancer du sein avec récepteurs hormonaux (RH) positifs et HER2 négatif. Dans l’étude TAILORx, il a été établi qu’en l’absence d’atteinte ganglionnaire, le bénéfice de la chimiothérapie était réel en cas de risque de récurrence intermédiaire, chez les patientes non ménopausées. L’objectif de RxPonder était de déterminer l’effet de la chimiothérapie sur la survie sans maladie. Les patientes concernées présentaient un cancer du sein RH positifs, HER2 négatif, un à trois ganglions atteints (atteinte ganglionnaire limitée) et un score de récurrence compris entre 0 et 25 (test Oncotype Dx®). Ces patientes étaient réparties entre deux groupes, l’un avec chimiothérapie puis hormonothérapie et l’autre avec hormonothérapie seule. 5 000 patientes ont été incluses dans l’étude et ont été suivies pendant 5,1 ans. Concernant les patientes ménopausées, la chimiothérapie n’apporte pas de bénéfice en terme survie sans maladie (HR =0,97 ; IC 95 % [0,78-1,22], p=0,82. Cependant, pour les patientes non ménopausées, la chimiothérapie améliore significativement la survie sans maladie comparativement à l’hormonothérapie seule. (HR= 0,54 ; IC 95 % [0,36-0,76] p=0,0004]. En ce sens, la médecine prédictive a franchi encore un pas dans le cancer du sein, en affinant les critères de sélection des patientes ayant un réel bénéfice de la chimiothérapie.
Références :
1. RxPonder : First results from a phase III randomized clinical trial of standard adjuvant endocrine therapy (ET) +/- chemotherapy (CT) in patients (pts) with 1-3 positive nodes, hormone receptor-positive (HR+) and HER2-negative (HER2-) breast cancer (BC) with recurrence score (RS) < 25: SWOG S1007 (RxPonder). Kalinsky K. et al., Cancer Res February 15 2021 (81) (4 Supplement) GS3-00; DOI: 10.1158/1538-7445.SABCS20-GS3-00
2. TAILORx : Clinical Outcomes in Early Breast Cancer With a High 21-Gene Recurrence Score of 26 to 100 Assigned to Adjuvant Chemotherapy Plus Endocrine Therapy: A Secondary Analysis of the TAILORx Randomized Clinical Trial ; Sparano JA,.. JAMA Oncol. 2020 Mar 1;6(3):367-374. doi:10.1001/jamaoncol.2019.4794
Thoracique
Immunothérapie et mésothéliome pleural malin : une lueur d’espoir ?
Pamela Abdayem
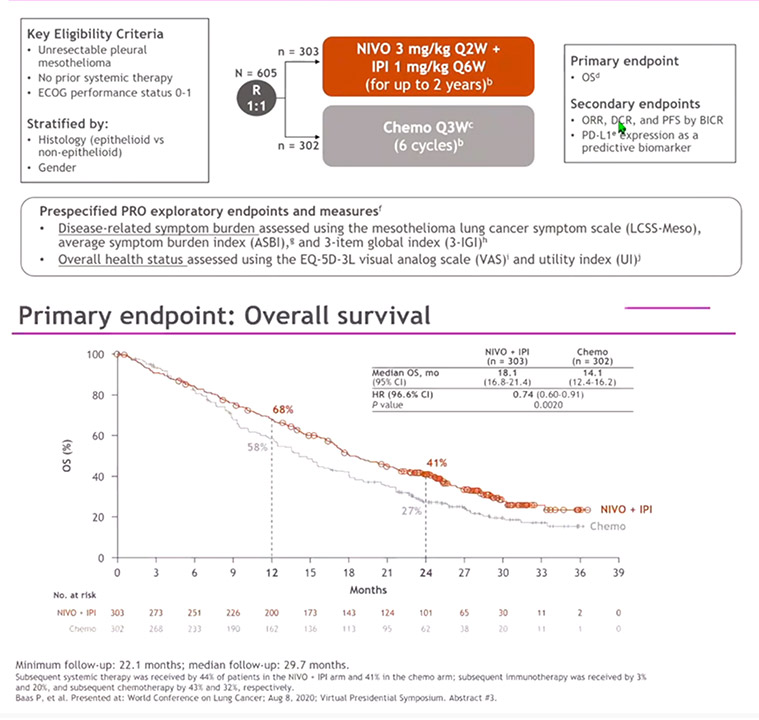
CheckMate 743 est la première étude randomisée montrant la supériorité d’une double immunothérapie par nivolumab et ipilimumab par rapport à une chimiothérapie classique de 1re ligne dans le mésothéliome pleural malin non résécable. Cette combinaison est actuellement approuvée par la FDA et figure parmi les traitements de 1re ligne recommandés par le National Comprehensive Cancer Network (NCCN).
Le mésothéliome pleural malin (MPM) est une maladie rare, dont l’incidence atteint 800-1 000 cas par an en France. Le facteur de risque principal de cette maladie demeure l’exposition aux fibres d’amiante avec une période de latence comprise entre 20 et 50 ans. Il s’agit d’une maladie agressive, le plus souvent non résécable, avec des survies médianes allant de 21 mois pour les stades I précoces à 12 mois pour les stades IV métastatiques. Le seul traitement standard de 1re ligne du MPM non résécable est une chimiothérapie palliative comportant un sel de platine (cisplatine ou carboplatine) et du pemetrexed administrés une fois toutes les trois semaines pendant six cycles (essai de phase III EMPHACIS en 2003, taux de réponse 41,3 %, survie médiane 12,1 mois [1]).
CheckMate 743 est un essai international, ouvert, de phase III, dans lequel 605 patients ont été tirés au sort entre deux groupes [2]. Le premier groupe a reçu une double immunothérapie par nivolumab et ipilimumab jusqu’à progression de la maladie ou une période maximale de deux ans. Le second groupe a reçu une chimiothérapie classique par sel de platine et pemetrexed toutes les trois semaines jusqu’à six cycles au total. Le critère de jugement principal était la survie globale. A 29,7 mois de suivi médian, la survie globale était supérieure dans le bras immunothérapie par comparaison à la chimiothérapie (survie médiane 18,1 mois versus 14,1 mois ; Hazard ratio 0,74 [96,6 % IC 0,60–0,91] ; p=0,0020). Le taux de survie à deux ans était de 41 % dans le bras immunothérapie versus 27 % dans le bras chimiothérapie. L’incidence des effets secondaires graves (grade 3 et 4) était comparable entre les 2 groupes (30 % bras immunothérapie versus 32 % bras chimiothérapie). Le bénéfice en survie était également présent dans le sous-type histologique non-épithélioide qui répond très peu à la chimiothérapie.
Les résultats de cette étude ont permis l’utilisation de cette combinaison aux États-Unis en tant que nouveau standard chez les patients ayant une MPM naïfs de traitement. L’autorisation de mise sur marché en Europe est en cours de traitement.
Références :
- Vogelzang NJ, Rusthoven JJ, Symanowski J, Denham C, Kaukel E, Ruffie P, Gatzemeier U, Boyer M, Emri S, Manegold C, Niyikiza C, Paoletti P. Phase III study of pemetrexed in combination with cisplatin versus cisplatin alone in patients with malignant pleural mesothelioma. J Clin Oncol. 2003 Jul 15;21(14):2636-44. doi: 10.1200/JCO.2003.11.136. PMID: 12860938.
- Baas P, Scherpereel A, Nowak AK, Fujimoto N, Peters S, Tsao AS, et al. First-line nivolumab plus ipilimumab in unresectable malignant pleural mesothelioma (CheckMate 743): a multicentre, randomised, open-label, phase 3 trial. The Lancet. 2021 Jan 30;397(10272):375–86. DOI:https://doi.org/10.1016/S0140-6736(20)32714-8
Urologie
L’enfortumab, un nouveau médicament contre le cancer de la vessie
Yohann Loriot
L’étude EV-301 démontre l’efficacité de l’enfortumab vedotin, un anticorps conjugué, pour lutter contre l’évolution des métastases de cancer des voies urinaires.
Les anticorps conjugués constituent une nouvelle classe de médicaments qui améliorent la prise en charge de plusieurs types de cancers solides. Ainsi, l’étude EV-301 publiée dans le NEJM devrait conduire à l’autorisation de mise sur le marché de l’enfortumab vedotine (EV) dans le cadre de la prise en charge des patients atteints de cancer des voies urinaires métastatiques. Cet anticorps conjugué (ADC) reconnait une protéine membranaire, la nectin-4 dont l’expression est estimée à plus de 90 % des cancers des voies urinaires. L’auristatine constitue la chimiothérapie greffée à l’anticorps. Les essais précoces avait permis d’observer une efficacité particulièrement encourageante chez des patients dont la maladie était avancée. Ces données préliminaires ont conduit à l’autorisation de mise sur le marché par la FDA aux États-Unis et au développement d’une étude internationale à laquelle Gustave Roussy a participé (Dr Loriot). Dans cette étude, les patients inclus avaient été traités antérieurement par une chimiothérapie et une immunothérapie. Dans cette situation, le traitement retenu dans le bras contrôle reposait sur une chimiothérapie cytotoxique conventionnelle. Le bras expérimental consistait en l’administration de l’EV toutes les semaines. Le risque de décès est diminué de 30 % avec l’EV. La survie sans progression a été meilleure chez les patients traités par EV. Enfin, le taux de réponse a reproduit celui observé au cours des essais précoces (40 %). Globalement, le traitement a été bien toléré. Les effets secondaires ont consisté surtout en une neuropathie périphérique sensitive et des éruptions cutanées parfois sérieuses. Compte-tenu de ces résultats, les sociétés savantes devraient considérer l’EV comme traitement standard en troisième ligne. L’EV est actuellement évaluée à des stades moins avancés (étude EV-302), en particulier en situation néoadjuvante avant cystectomie (étude MK-905), toutes deux ouvertes à Gustave Roussy.
Référence :
Powles T, Rosenberg JE, Sonpavde GP, Loriot Y, Durán I, Lee JL, Matsubara N, Vulsteke C, Castellano D, Wu C, Campbell M, Matsangou M, Petrylak DP. Enfortumab Vedotin in Previously Treated Advanced Urothelial Carcinoma. N Engl J Med. 2021 Feb 12. doi: 10.1056/NEJMoa2035807. Epub ahead of print. PMID: 33577729.
Essais précoces
Focus sur la modalité d’administration par injection intra-tumorale
Daphné Morel, Stéphane Champiat
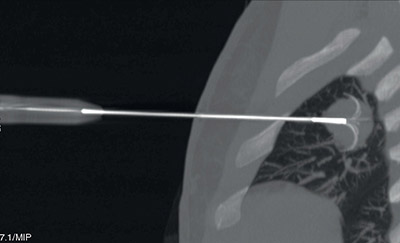
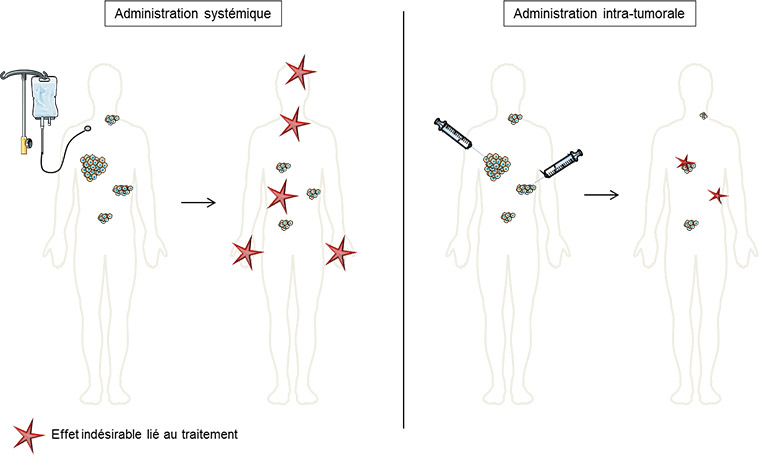
Actuellement, six essais ouverts au DITEP explorent l’injection intra-tumorale de composés immunomodulateurs. Comparativement aux immunothérapies intraveineuses, il est attendu que l’injection intra-tumorale limite les effets secondaires systémiques, notamment auto-immuns et inflammatoires, tout en déclenchant une réponse immune antitumorale ciblée – y compris envers les lésions non injectées.
Comme son nom l’indique, l’injection intratumorale est une modalité d’administration émergente consistant à injecter un composé anticancéreux directement dans une ou plusieurs lésions tumorales, plutôt que par voie orale ou veineuse (cf. figure). Les types de composés actuellement étudiés sont très variables : anticorps monoclonaux ou bispécifiques, virus/peptides oncolytiques, lymphocytes T modifiés, etc. D’un point de vue pratique, le geste est similaire à une biopsie (bien que l’aiguille soit plus fine), et peut donc être réalisé par le personnel habilité à biopsier, y compris les radiologues, radiologues interventionnels et les endoscopistes pour les lésions les plus profondes.
L’équipe du DITEP participe activement au développement clinique de composés injectés en intra-tumoral. Récemment, l’étude de phase I ayant évalué le LTX-315 (peptide oncolytique) en injection intra-tumorale a montré un profil de tolérance largement acceptable – majoritairement des hypotensions (46,1 % des patients, dont 2,5 % de grades 3-4), des rougeurs du visage (28,2 % des patients, 2,5 % de grades 3-4), des démangeaisons (15,4 %) et un rash (15,4 %).
Du point de vue de l’efficacité, sur 24 patients évalués, 29 % ont présenté une diminution significative (> 30 %) du volume de la lésion injectée, et 89 % ont présenté une infiltration lymphocytaire CD8+, témoignant de l’activation locale du système immunitaire contre la tumeur.
De manière intéressante, presque la moitié des patients ont vu des lésions tumorales régresser (jusqu’à 82 % du volume initial) alors que ces lésions n’avaient pas été injectées par le produit. Ce phénomène, appelé effet abscopal et bien connu en radiothérapie, témoigne de l’action systémique (« généralisée ») du système immunitaire activé par le LTX-315, malgré une administration localisée.
Références :
- Intratumoral Immunotherapy: from Trial Design to Clinical Practice. Champiat S, Tselikas L, Farhane S, Raoult T, Texier M, Lanoy E, Massard C, Robert C, Ammari S, De Baere T, Marabelle A. Clin Cancer Res. 2021 Feb 1;27(3):665-679. doi: 10.1158/1078-0432.CCR-20-0473
- Safety, anti-tumor activity and T-cell responses in a dose-ranging phase 1 trial of the oncolytic peptide LTX-315 in patients with solid tumors. James Spicer, Aurelien Marabelle, Jean-Francois Baurain, Nina Louise Jebsen, Dag Eirik Jøssang, Ahmad Awada, Rebecca Kristeleit, Delphine Loirat, George Lazaridis, Christiane Jungels, Paal Brunsvig, Berit Nicolaisen, Andrew Saunders, Hamina Patel, Jerome Galon, Fabienne Hermitte, Ketil André Camilio, Brynjar Mauseth, Vibeke Sundvold, Baldur Sveinbjørnsson, Øystein Rekdal. Clin Cancer Res. 2021 Feb 4;clincanres.3435.2020. doi: 10.1158/1078-0432.CCR-20-3435
Recherche / Hématologie
Caractérisation des cellules souches leucémiques pour identifier des cibles thérapeutiques
Lucie Laplane, Ileana Antony-Debré, Aline Renneville
Les cellules souches cancéreuses sont la source du développement et de la progression de nombreux cancers et représentent donc une cible thérapeutique majeure. Mais ces cellules sont difficiles à identifier, à caractériser et donc à cibler. Velten et al. proposent une nouvelle technique d’analyse unicellulaire permettant d’identifier des signatures moléculaires leucémiques spécifiques pouvant conduire à de nouvelles cibles thérapeutiques.
Les cellules souches cancéreuses sont la source du développement et de la progression de nombreux cancers et représentent donc une cible thérapeutique majeure. Mais ces cellules sont difficiles à identifier, à caractériser et donc à cibler. Velten et al. introduisent une nouvelle technique d’analyse unicellulaire appelée MutaSeq combinant une analyse de mutations d’ADN et une analyse transcriptomique. En plus de l’analyse des mutations acquises de l’ADN nucléaire, les auteurs utilisent les mutations de l’ADN mitochondrial pour améliorer la reconstruction de l’histoire évolutive des cellules. Ces améliorations leur permettent de mieux discriminer les cellules normales, les cellules pré-cancéreuses (qui ont acquis des mutations dites « driver ») et les cellules cancéreuses (qui ont acquis des mutations additionnelles aboutissant à l’émergence de la maladie cancéreuse). Ils peuvent ensuite distinguer, au sein de ces populations, le stade de différenciation des cellules grâce à leur profil d’expression génique.
En appliquant cette technique à quatre patients atteints de leucémies aiguës myéloïdes, ils ont pu étudier l'effet des mutations sur la différenciation hématopoïétique et l’expression des gènes. Ils ont également montré que la signature moléculaire des cellules souches cancéreuses pouvait être très proche de celle des cellules souches normales et que les gènes différentiellement exprimés, comme FOS, pourraient représenter une stratégie thérapeutique potentielle pour cibler préférentiellement les cellules souches leucémiques.
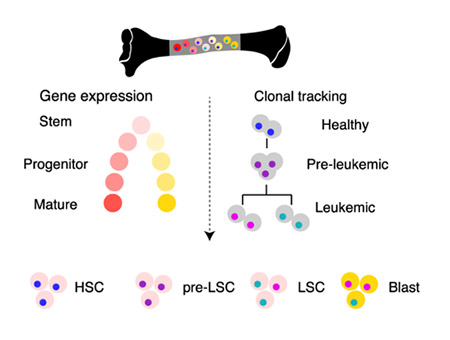
Référence :
Velten, L., Story, B.A., Hernández-Malmierca, P., Raffel, S., Leonce, D.R., Milbank, J., Paulsen, M., Demir, A., Szu-Tu, C., Frömel, R., et al. (2021). Identification of leukemic and pre-leukemic stem cells by clonal tracking from single-cell transcriptomics. Nat Commun 12, 1366. 2021 Mar 01. doi : 10.1038/s41467-021-21650-1
Recherche
Aurons-nous l’information intégrale de notre génome dans notre smartphone en 2030 ?
Ken Olaussen

La compréhension du génome humain a eu des répercussions majeures sur la compréhension des cancers et a permis de faire émerger de nombreuses nouvelles thérapies anti-cancéreuses. Le NHGRI, l’institut national américain de recherche sur le génome humain, a récemment publié dans le journal Nature une réflexion collective sur les priorités et opportunités de la recherche sur le génome humain et leurs implications pour la santé humaine à l’horizon 2030. Selon eux, la nouvelle frontière de la génomique humaine devra être définie dans un cadre stratégique global bien précis.
Le cadre stratégique global proposé par les chercheurs du NHGRI pour garantir les progrès en génomique humaine consiste en quatre domaines principaux qui sont les suivants :
1) Réaffirmer un certain nombre de principes et de valeurs fondamentales communes pour guider la communauté de recherche génomique (prioriser la compréhension de la biologie et la connaissance des maladies, assurer une diversité d’origines génétiques dans les études, inclure les facteurs sociaux et environnementaux, assurer l’interdisciplinarité, créer des standards robustes et une sécurisation des données, adhérer au principe de science ouverte…).
2) Consolider les fondations mêmes de la génomique (générer et analyser en routine des data génomiques hautement complexes, développer la data science, construire des véritables « bases de connaissances » (knowledgebases) intégratives associées et des méthodes informatiques dédiées à la génomique médicale, renforcer la formation et impliquer la Société dans le processus…).
3) Casser certaines barrières qui empêchent les progrès en génomique (changer radicalement d’échelle en termes de synthèse d’ADN et de notre capacité à l’éditer en nombre pour identifier plus facilement la conséquence fonctionnelle des nombreuses variantes génomiques, et implémenter réellement la science génomique dans la pratique clinique).
4) Promouvoir des projets impérieux en biomédecine (acquérir une vision complète des rôles et des relations des gènes et des éléments de régulation des voies et des différents réseaux de signalisation cellulaire, déterminer l'architecture génétique des maladies et des traits humains, comprendre comment l'utilisation de la génomique peut influencer les concepts de santé, de maladie, de responsabilité, d'identité, de famille et de communauté). Dans ces projets impérieux se trouve notamment l’importance du dynamisme « bench to bedside » et « back to bench ».
Ce cadre étant posé, les chercheurs du NHGRI prédisent qu’à l’horizon 2030 que la production et l'analyse d'une séquence complète du génome humain seront des opérations de routine pour tout laboratoire de recherche et seront courantes dans la pratique clinique. De plus, pas seulement la pertinence clinique de toutes les variantes génomiques rencontrées sera facilement prévisible, mais les fonctions biologiques de chaque gène humain seront connues. Ce sera également le cas pour la majorité des éléments non codants du génome humain. Le paysage épigénétique et l’état transcriptionnel correspondant seront systématiquement intégrés dans les modèles de prévision. Les découvertes conduiront à des thérapies curatives impliquant des modifications génomiques pour des douzaines de maladies génétiques.
Enfin, et croyez-le ou non, la séquence complète du génome d'un individu ainsi que des annotations informatives seront, si vous le souhaitez, accessibles facilement et en toute sécurité sur votre smartphone. Cela pourrait en particulier avoir un rôle très important dans la mise en place d’un programme de prévention anticancéreuse personnalisée, et in fine diminuer l’incident et la mortalité du cancer dans le monde.
Référence :
Green ED, Gunter C, Biesecker LG, et al. Strategic vision for improving human health at The Forefront of Genomics. Nature. 2020 Oct;586(7831):683-692. doi: 10.1038/s41586-020-2817-4.
Abonnez-vous à la newsletter Good to Know
Ne manquez pas les prochains numéros de la newsletter Good to Know : abonnez-vous !
Crédits photos : Adobe Stock, Gustave Roussy.
