Inflammation et plasticité cancéreuse
Cette équipe est rattachée à l'UMR 981- Biomarqueurs prédictifs et nouvelles stratégies thérapeutiques en oncologie
Les cellules de nos tissus accumulent des mutations cancéreuses tout au long de la vie. Cependant, toutes ne se transforment pas en tumeurs. Notre laboratoire étudie les mécanismes qui poussent certaines cellules mutées à devenir cancéreuses chez certaines personnes alors que d’autres ne le deviennent pas. Nous nous intéressons notamment à la manière dont l’obésité et les troubles métaboliques augmentent le risque de cancers du poumon et du pancréas, qui présentent souvent des mutations sur un gène appelé KRAS, responsable de la progression de ces cancers.
Thèmes de recherche
Des mutations oncogéniques responsables de cancers s’accumulent au cours du temps dans les tissus. Pourtant, la plupart ne conduisent pas à des tumeurs malignes. Le laboratoire Inflammation et Plasticité du Cancer fait partie de l’unité Inserm U981 et de l’IHU Prism à Gustave Roussy. Notre équipe cherche à comprendre les mécanismes moléculaires et cellulaires qui favorisent la transformation de cellules porteuses d’une mutation oncogénique.
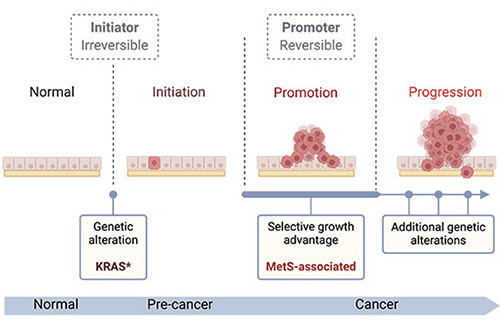
Nous nous intéressons particulièrement aux cancers présentant des mutations fréquentes de KRAS dans le contexte de maladies métaboliques associées à l’obésité et à l’alimentation. KRAS, un membre de la famille des oncogènes RAS, est fréquemment muté dans les cancers, conduisant à l’activation continue de voies de signalisation qui induise la prolifération, favorise la motilité et inhibe la mort cellulaire. Les mutations activatrices de KRAS touchent environ 30 % des adénocarcinomes pulmonaires (LUAD) et 90 % des adénocarcinomes canalaires pancréatiques (PDAC). Le cancer du poumon reste la principale cause de mortalité par cancer dans la population. De son côté, le PDAC représente l’un des plus agressifs cancers et connait des taux d’incidence en hausse, notamment chez les moins de 50 ans.
LUAD et PDAC sont tous deux associés à l’obésité et au syndrome métabolique (MetS)—un ensemble d’anomalies métaboliques diagnostiqué lorsqu’un individu présente au moins trois de ces critères : obésité centrale, hypertension, hyperglycémie et dyslipidémie (triglycérides élevés ou faible taux de cholestérol HDL). L’obésité et le MetS sont en augmentation dans la population générale et chez les enfants, soulignant l’urgence de comprendre comment ces conditions favorisent l’initiation et la progression du cancer.
Notre recherche couvre plusieurs domaines de la biologie du cancer ainsi que leurs interactions :
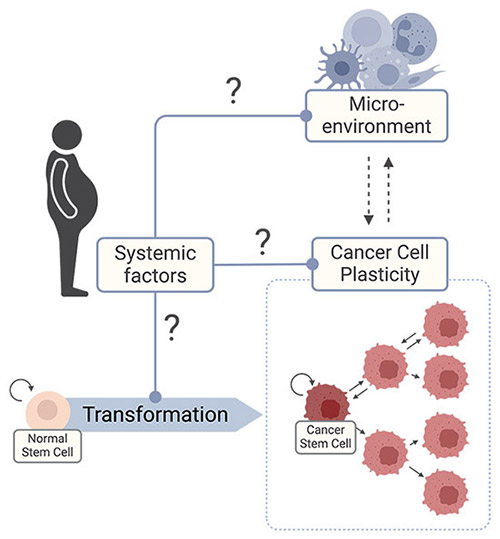
- Plasticité des cellules cancéreuses – Comprendre comment les maladies métaboliques influencent l’hétérogénéité transcriptionnelle des cellules cancéreuses, en particulier leurs effets sur les cellules souches cancéreuses (CSCs), responsables de la progression tumorale et des rechutes après traitements.
- Microenvironnement tumoral (TME) – Explorer les interactions entre les cellules cancéreuses et immunitaires et comprendre comment les maladies métaboliques influences cette dynamique pour façonner l’évolution tumorale.
- Promoteurs systémiques de la progression tumorale – Identifier les facteurs systémiques qui favorisent les cancers KRAS mutés chez les personnes souffrant de syndrome métabolique (MetS) et comprendre comment l’inflammation systémique et les troubles métaboliques contribuent à l’évolution du cancer.
Pour répondre à ces questions, nous intégrons des échantillons dérivés de patients, des modèles précliniques et des technologies de profilage moléculaire avancées :
- Échantillons dérivés de patients – En collaboration avec le programme Interception de Gustave Roussy, nous accédons à des échantillons cliniques de personnes à risque de développer un cancer ou déjà atteintes d’une tumeur avérée. En recueillant les données cliniques et des échantillons appariés (tumeurs bénignes et malignes) chez les mêmes individus, nous étudions la présence de mutations oncogéniques et le microenvironnement tumoral dans les tissus normaux et tumoraux. Ces données sont corrélées avec des facteurs cliniques et environnementaux pour identifier de nouveaux facteurs de risque et élucider leur impact sur l’initiation et la progression du cancer.
- Modèles précliniques – Nous utilisons des modèles murins génétiquement modifiés (GEMMs) présentant des mutations oncogéniques inductibles et des systèmes de suivi (tracking) conçus pour étudier l’initiation et la progression tumorales dans des conditions contrôlées reproduisant des facteurs de risque spécifiques aux patients. Nous utilisons également des systèmes d’organoïdes dérivés de cellules souches pluripotentes induites (iPSCs) pour modéliser l’évolution tumorale in vitro de manière contrôlée, permettant une caractérisation des voies moléculaires impliquées.
- Profilage moléculaire avancé – Nous appliquons des approches de séquençage unicellulaire (e.g., CITE-Seq, scRNA-Seq) et de transcriptomique spatiale afin de disséquer les paysages cellulaires et moléculaires de l’initiation et de la progression tumorales à l’échelle cellulaire. Ces technologies offrent une vision inédite de l’hétérogénéité transcriptionnelle et spatiale des populations tumorales et immunitaires.
En décryptant les mécanismes qui sous-tendent l’initiation et la progression tumorales chez des individus à risque accru de cancer, notre travail vise à informer de nouvelles stratégies de prévention, à sensibiliser aux facteurs de risque modifiables et à développer de nouvelles interventions thérapeutiques précoces pour les patients à risque.
